【飞诺美色谱】封面故事专题 | ADC药物的液相色谱-质谱分析解决方案
时间:2024-12-10 阅读:91
抗体偶联药物(ADC)是一种将小分子细胞毒素药物通过连接子与单克隆抗体偶联形成的药物。与传统的小分子化学治疗以及抗肿瘤单抗相比,ADC药物不仅可以提高化学治疗的疗效和肿瘤细胞的特异性,还可以降低或减弱系统毒性以及非靶向细胞毒性。ADC结构复杂,异质性高,存在多种产品相关的杂质,其理化性质分析与结构表征不仅包括单抗部分,还包括小分子药物相关的质量属性,可见ADC的质量属性研究较抗体更为复杂。本期#封面故事我们将围绕药物抗体比(Drug-to-antibody ratio, DAR)关键质量属性,阐述ADC药物的质量分析与控制的进展与综合分析方案。

ADC药物经过90多年的发展,特别是近来20多年的高速发展,目前经过定点偶联技术是第三代ADC药物成功开发的关键。小分子毒素与单克隆抗体的位点特异性结合确保ADC药物具有明确、均一的DAR值(通常为2或4),这样可以使药物毒性降低,稳定性和药代动力学显著提高。第三代ADC药物采用的位点特异性偶联技术主要包括Thiomab、ThioBridge、引入非天然氨基酸、引入序列标签或聚糖等。

药物抗体比(Drug-to-antibody ratio, DAR)指抗体偶联上毒素小分子数量的平均值,直接反映了靶向肿瘤细胞的载荷数量,同时影响药物的安全性与有效性。如下图 所示,DAR的分析方法主要分为二类:
A. 液相色谱法(HPLC-UV)
B. 质谱法(LC-MS)
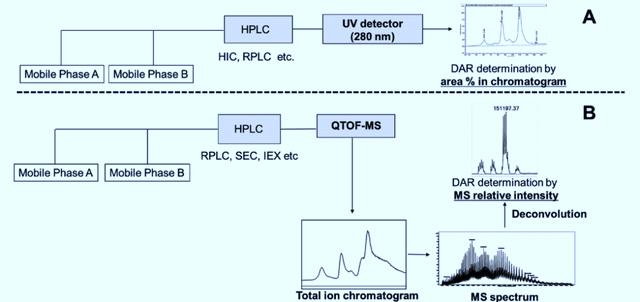
液相色谱法(HPLC-UV)
1) HIC-UV分析法:
疏水作用色谱(HIC-HPLC)是根据抗体偶联不同数量的细胞毒性小分子之间疏水性不同,也即是具有不同DAR的ADC分子可在HIC中实现分离,未偶联小分子药物的抗体疏水性最弱,优先被洗脱,偶联小分子药物数量越多的抗体,其疏水性就越强,典型谱图见下图 。

HIC-UV分析mAb与ADC谱图
HIC是在非变性条件下进行的,不仅可以用于不同DAR分子的分离,还可以用于纯化,进一步对分离纯化后的HIC各组分进行深度研究。
一般情况下,半胱氨酸的偶联方式之一,是将抗体部分还原,打开链间二硫键,游离半胱氨酸上的巯基(-SH)与毒素小分子-连接子上的马来酰亚胺基团反应形成DAR=0-8分子异质体ADC。依据计算公式DAR=∑(Weighted Peak Area)/100,最终得到加权平均DAR=3.6。
2) RPLC-UV方法:
反相高效液相色谱法(RP-HPLC)通常是在还原水平上分析DAR,即通过非变性还原条件下打开链间二硫键,然后根据待测物质的极性大小进行分离,具有更好的分离度与分辨率。理论上基于半胱氨酸偶联方式ADC经过还原前处理后得到6种亚基分子类型,分别是L0、L1、H0、H1、H2与H3,见下图所示:

基于半胱氨酸偶联方式ADC的还原前处理
这里我们可以看到通过连接物与MMAF偶联的曲妥珠单抗的DAR。该抗体通过部分还原使链间二硫键变为半胱氨酸残基,之后该残基再与小分子药物通过连接物形成一种药物抗体偶联物。在此色谱图中,我们可以观察到重链和轻链,连接有小分子药物或者没有连接小分子药物片段,分别用H0-H3和L0/L1来表示。DAR通过将H0-H3, L0和L1的峰面积相加来确定,并决定它们对mAb的贡献,然后再取平均值。

曲妥珠单抗Mc-MMAF半胱氨酸偶联物的平均DAR
色谱柱:bioZen Intact XB-C8,3.6μm
货号:00F-4766-AN
规格:150x2.1mm
流动相A:0.1%TFA水溶液
流动相B:0.1%TFA in ACN
流速:0.4mL/min
检测:LC-UV(280nm)
样品:曲妥单抗mcMMAF半胱氨酸偶联物(来源于ADC BiotechnologyLTD)
仪器:UPLC-UV
这里,我们采用了Phenomenex的bioZen Intact XB-C8色谱柱,此款色谱柱是core-shell结构,类似于经典的Kinetex系列:

对于ADC的Dar值分析,具有以下优点:
• 优化的颗粒形态可实现更高效率的Intact RP
• 改善蛋白质回收率
• 高温稳定性<90°C
以相同的分析方式,我们可以将标准子单元的分析平台化,同时,也可以将具有不同linker的ADC平台化。这样可以加快分析速度。

色谱柱:bioZen3.6μmXB-C8
货号:00F-4766-AN
规格:150x2.1mm
流动相A:0.1%TFA in 水
流动相B:0.1%TFA in 乙腈
流速:0.4mL/min
梯度:
28-34%B in 1-4minutes
34-65%B in 4-10minutes
检测器:UV-Vis,280nm
温度:80°
样品:如图所示
随着越来越多的研究者采用特定位点的偶联技术来提高治疗效果和降低毒性,ADC的同质化程度将会越来越高,DAR的分析也将变得更加简单。但是,随着新型细胞毒素和连接物以及偶联方法的增加,有效载荷复杂性不断增加,这一趋势将使DAR测定更多地转向LC-MS技术,以利用其高分辨率分析能力。
质谱法(LC-MS)
质谱法可分为变性与非变性电喷雾质谱法,两种不同的方法均是根据物质的分子量差异进行DAR的分析。抗体偶联上不同数量细胞毒性小分子后,ADC呈现分子异质性,不同的DAR物质在高分辨质谱的分析下具有不同的质荷比(m/z),然后根据相对应的DAR质谱信号峰强度或峰面积计算平均DAR值。
1) 变性质谱法(Denatured MS)
通常情况下,DAR在变性质谱分析中,会使用到有机试剂流动相与相对较高的柱温,ADC在这两种条件的共同作用下,非共价键连接的空间结构被破坏,然后经过电喷雾携带相对较多的电荷(H+),进而产生信噪比(S/N)较好的质谱峰图。
变性质谱常应用于ADC赖氨酸偶联方式的DAR分析,因其分子异质性较高,往往在进行质谱分析之前,需要对其进行去糖基化处理或者使用CPB酶去除C端赖氨酸的影响,以减少图谱的复杂程度,便于后续的峰归属及最终的平均DAR计算。

Kadcyla ADC与生物类似药ADC的去糖基化
2) 非变性质谱法(Native MS)
非变性质谱使用与质谱兼容的流动相体系,以及相对较低的柱温与更温和的电离方式,在不破坏物质非共价键连接的立体空间结构情况下,让ADC生物大分子在气相中保持自然折叠状态,既可以用于ADC链间半胱氨酸偶联方式的DAR分析,也可以用于赖氨酸偶联方式的DAR分析。
HIC-MS非变性质谱可与HIC-HPLC质量放行方法相结合用于DAR的分析与质控,具有高效率与高通量等特点。
SEC-MS非变性质谱也常用于ADC DAR的分析与质控。相对HIC-MS来说,流动相可选择挥发性的盐溶液,与质谱更兼容些。
我们分析了从Sigma购得的市售半胱氨酸连接的ADC 模拟物,使用bioZen SEC-2与SCIEX® X500B联用鉴定DAR 0到8。根据提取离子色谱图,每种药物抗体蛋白型都用于计算DAR。平均DAR计算为3.4,与Sigma报告值4.0±0.8匹配。我们看到在“天然”条件下,ADC保持完整,从而可以观察到不同的DAR种类,并且可以标记DAR和糖型。

LC Conditions
Column:bioZen 1.8μm SEC-2
Dimension:150x4.6mm
Part No.:00F-4769-E0
Recommended Guard:SecurityGuard™ ULTRA
Guard Cartridge Part No.:AJ0-9850
Guard Holder Part No.:AJ0-9000
Mobile Phase:100mM Ammonium Acetate
Flow Rate:200μL/min
Temperature:25℃
Detector:QTOF(SCIEX X500B)
Sample:Sigma ADC Mimic(MSQC8),100μg
这里我们用到了bioZen 1.8µm dSEC色谱柱,这款色谱柱的特点一是采用了低孔隙体积的硅胶,实现更好的稳定性和重现性。二是采用了亲水性二醇类键合表面,能够防止硅胶表面与蛋白质样品相互作用。

比如我们还可以见到很多高分辨质谱上的应用:
Intact Mass:Cysteine-based conjugation (DAR)

同时,对于半胱氨酸偶联的ADC药物,可以采用非变性的模式进行分子量的检测,从而分析DAR值。

半胱氨酸偶联的ADC药物质谱检测图谱
对于ADC药物的开发而言,如何依据药物的偶联方式及目标属性去选择合适的质量控制方法、质量控制项目与性质合适的耗材,是助力药物从理论设计走向实验室制备的重要环节。本文总结的几种ADC药物DAR值分析方法,不仅能给用户提供不同的选择,还能帮助用户进行不同方法的相互验证,确保结果的准确性。
后面我们会继续跟踪行业的进展,给大家最及时的技术交流和分享。更多内容,详见《2023飞诺美色谱产品指南》

《下载2023飞诺美色谱产品指南》
