PCR扩增效率的评估-扩增曲线的解读
时间:2021-03-28 阅读:7141
做过PCR的小伙伴都知道,PCR前期的验证引物探针性能和确定最适反应条件是确保正式实验顺利进行的前提。PCR实验中有个相当重要的工作——即是PCR扩增效率的评估。扩增效率是PCR检测性能最重要的指标之一,也是定量分析计算结果时所需要的参数。接下来,让小编给大家细细说来吧。
什么是扩增效率
PCR是一种DNA体外扩增技术,通常包括了30 - 50个循环周期。每个循环中,目标DNA分子的拷贝数最多会增加1倍。但在实际反应中,1个DNA分子在1个扩增循环后被成功复制的概率,也就是扩增效率E<1。而PCR的特点是反应初期目标DNA分子呈现指数增长,这个阶段的扩增效率可以无限接近于1;随后由于反应组分消耗或聚合酶活性下降或两者共同作用,导致反应效率逐渐下降并最终停止。不管是定量DNA分子初始量,还是计算表达量差异,都需要精评估PCR扩增效率。
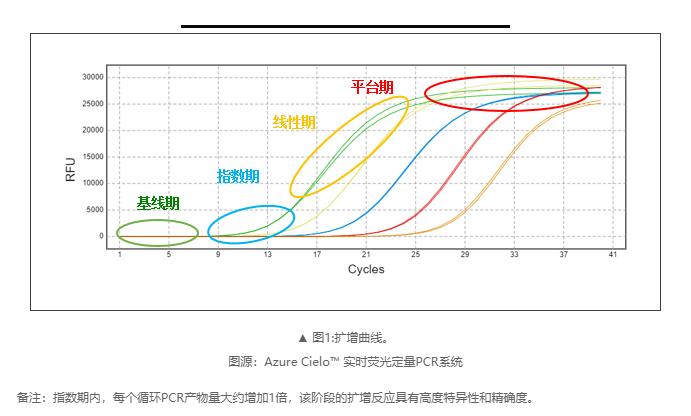
如何评估扩增效率
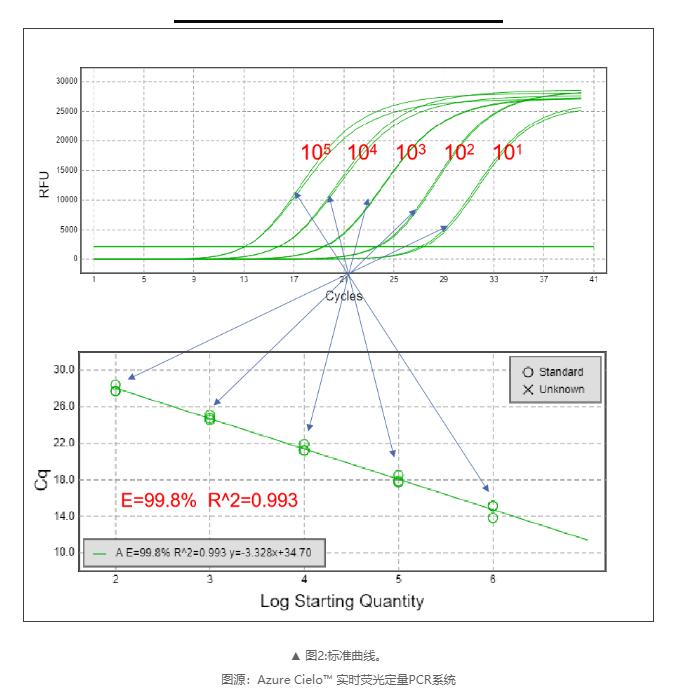
标准曲线是评估PCR扩增效率可靠和稳定的一种方法,被研究者们广泛认可。该方法涉及到制作一系列的样品来控制目标模板的相对数量。这些样品通常由浓缩的原液连续稀释而成,常用的是10倍稀释。使用一系列稀释样品,采用标准qPCR程序进行扩增获得Cq值,最后根据各样品浓度及相应的Cq值绘制标准曲线,得到线性方程Cq= -klgX0+b,扩增效率E=10(-1/k)-1。利用qPCR进行定量分析时,要求扩增效率范围在90%-110%(3.6>k>3.1)。
影响扩增效率的关键因素
PCR的效率取决于许多因素,包括以下方面:
1)检测的性能。这取决于引物、模板的序列和结构。二级结构和分子间的相互作用都会降低PCR效率。
2)样品基质。其中可能含有来自样品的抑制剂和其他干扰物质,或携带来自上游加工步骤的试剂。检测样品是否有抑制作用,可使用RNA或DNA Spikes方法进行检测,或者通过倍比稀释得到标准曲线也可以观察到。
3)所用试剂及其浓度。本质上,任何PCR试剂都会一定程度上限制PCR反应速率和性能。
4)竞争性反应。多重反应时,各基因的扩增存在反应成分的竞争。
5)qPCR仪器。由于仪器特定的硬件/软件属性和设置、以及用于提取Cq值的特定算法不同,相同的实验中,不同的仪器会产生不同的PCR效率。
6)技术重复。一般进行3次以上的技术重复以校正实验误差,重复数越多精度越高。
7)连续稀释中的移液体积。移液体积越大,移液器误差或操作误差引起的影响越小。
qPCR扩增效率的判断
qPCR扩增效率主要是通过标准曲线的线性关系方程Cq=-klgX0+b来判断,扩增效率E在90%-110%之间时,认为扩增接近理想情况;参数R2要求≥0.98,R2越接近1,则说明Cq和X0的Log值之间的相关性越高。
那么扩增效率E表现不好,主要分为两种情况:
1)过低的扩增效率(<90%)
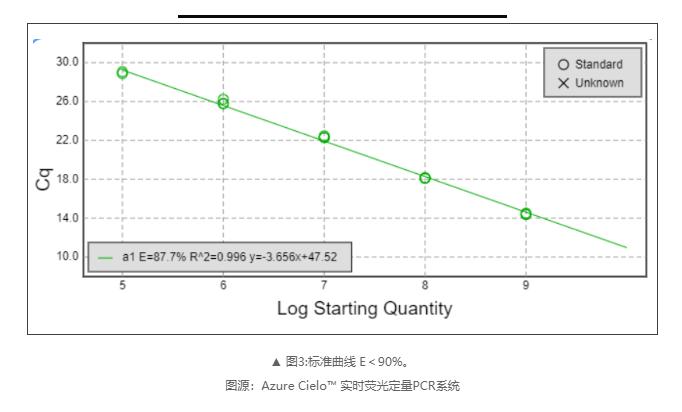
可能存在的原因:
☑ 移液器校准不良或移液技术差。
☑ 不正确的稀释导致标准曲线出现错误。
☑ 染料浓度低荧光或者仪器未校准染料。
☑ 引物设计不好或扩增子具有二级结构。
☑ 标准曲线动态范围太小。
☑ Taq酶无活性或活性降低。
☑ 样品抑制。
2)过高的扩增效率(> 110%)
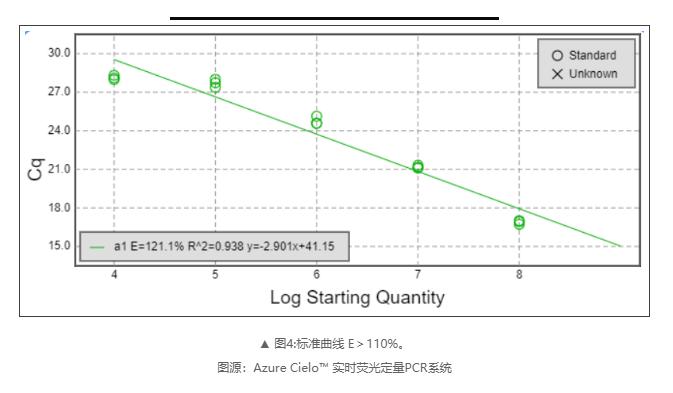
可能存在的原因:
☑ 移液器校准不良或移液技术差。
☑ 不正确的稀释导致标准曲线出现错误。
☑ 引物二聚体或非特异性扩增。
☑ 标准曲线动态范围太小。
☑ 基因组DNA污染(仅限RNA模板未进行DNase I处理或DNase I消化不*)。
