小酌怡情,但如何检测藏在葡萄酒及其软木塞的TCA?
时间:2021-01-27 阅读:680
“默克分析化学”公众号为您提供全面的分析化学行业应用和解决方案。我们将定期邀请行业专家,分享前沿技术解读、行业应用和热门科研分析。
本期我们邀请到的是中国食品发酵工业研究院有限公司高红波老师
背景介绍:
2,4,6-三氯苯甲醚(TCA)
是霉菌代谢含有三氯苯酚等一系列含氯的化合物经过复杂的反应后产生的化学副产物[1],一般认为高于10 ng/L超痕量TCA就会对葡萄酒的风味和品质产生影响,使葡萄酒产生一种类似潮湿地下室或湿报纸的霉味[2]。TCA是非常稳定的化合物,灌瓶后渗透到葡萄酒中的TCA比葡萄酒本身更稳定[3]。每年给葡萄酒工业带来巨大的经济损失。
由于这种污染主要是由封装葡萄酒的软木塞引起的,橡木塞由于其特殊的性能又很难用其他的螺旋塞等代替,因此建立一套能对葡萄酒和软木塞中TCA进行检测与分析定量的既精.确又高效的方法就愈发的重要,从而对葡萄酒在生产和储藏过程中的每一个环节进行有效地质量控制,达到控制污染水平的目的。
分析方法简介
样品前处理技术是葡萄酒和软木塞中TCA检测的关键,目前国内外软木塞中TCA的方法主要是固相萃取(SPE)、固相微萃取(SPME)、离子迁移谱等[4-10]。
本文对固相微萃取技术测定TCA样品前处理条件进行研究,并通过方法学评价,建立了固相微萃取-GC-ECD法测定软木塞及葡萄酒中超痕量TCA的方法,并开展了不同类型葡萄酒用软木塞和葡萄酒中TCA含量的测定,为葡萄酒企业开展葡萄酒用软木塞的测定提供有效途径。
1材料与方法
1.1仪器与试剂
气相色谱仪;
固相萃取头:涂层厚为100 µm的聚二甲硅烷氧烷纤维头(PDMS)。
乙醇(色谱纯);
2,4,6-三氯苯甲醚;
2,4-二氯苯甲醚(DCA)
氯化钠(分析纯)
葡萄酒样品(厂家提供),
1.2实验方法
1.2.1葡萄酒样品测定
- 取5mL葡萄酒样品于20ml顶空瓶中,
- 加入1.5 gNaCI,100μL 50μ/L的DCA标准液,压盖,进样。
1.2.2软木塞处理
- 取10~15 个软塞子于 500 mL试剂瓶,
- 加入300 mL12 %乙醇水溶液,使塞子*浸没,浸泡24 h±2 h。取 5 mL 浸泡液于 20 mL 顶空瓶中,以下步骤同1.2.1。
1.2.3 萃取及色谱条件
固相微萃取条件:
- 将顶空瓶置于恒温加热磁力搅拌器中,40℃平衡10min,
- 将固相微萃取头插入顶空瓶,在40℃持续搅拌下萃取30min,
- 然后在气相色谱进样口260℃解析时间:5 min。
气相色谱条件:
- 色谱柱:HP-5毛细管色谱柱(30 m×0.25 mm×0.25 μm)或等效色谱柱;
- 柱温:初温50℃,保持2 min,以9.0℃/min升到150℃,保持1 min,以20℃/min升到260℃,保持3 min;
- 进样口温度:260℃;
- 电子捕获检测器温度:330℃;
- 载气流量:1.0 mL/min;
- 进样方式:不分流进样;
2 结果与讨论
2.1 固相微萃取条件的优化
2.1.1 NaCI添加量的选择
无机盐NaCl的添加量对TCA的萃取效果具有重要影响。在溶液中加入NaCl,溶液的粒子强度增加,使有机分析物的非极性相对增强并使其在水溶液中的溶解度下降,萃取量得到增加,同时NaCl的加入还会影响基质粘度,降低分析物的扩散速度,产生盐的负效应。
本实验选择5mL样品,萃取温度40℃,对NaCl的加入量进行优化,发现随着NaCl量增加,TCA和DCA峰面积逐渐升高然后降低,当加入1gNaCl时两者峰面积达到大,结果见图1 因此选择加入1.5gNaCl。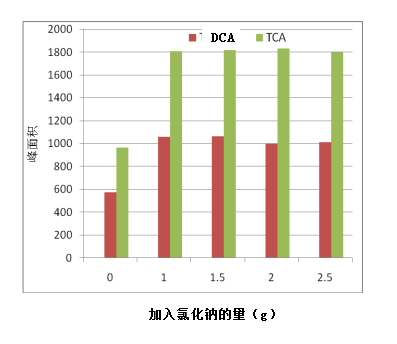
图1 NaCl的添加量对萃取效果的影响
2.1.2 萃取温度的选择
萃取温度对萃取效果的影响具有两面性:一方面,温度升高有利于有机组分从液体扩散到顶空部分
另一方面,温度升高又会使有机组分在吸附填料与样品中的分配系数降低,从而降低对被分析组分的吸附量。本文固定其它条件对吸附温度进行优化,由图2可见,吸附温度升高时吸附量有所增加,当温度由40℃提高到50℃时峰面积有所降低,所以选择40℃作为吸附温度。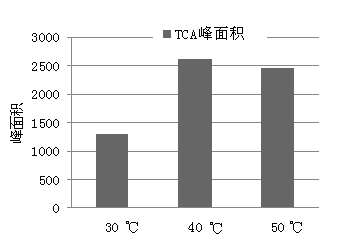
图2 萃取温度对萃取效果的影响
2.1.3 萃取时间的优化
SPME萃取时间对待测组分的萃取效果有较大的影响,固定萃取温度及溶液离子强度等其它条件不变,对不同萃取时间进行比较。取40ppt的TCA标准溶液加入1.5g氯化钠, 100µl 工作液(2.0ppt) 分别萃取10min 、20min 、30min 、40min(样品平衡时间均为5min)进行比较。由图3可见,吸附时间加长时TCA吸附量有所增加,当萃取时间到30min时峰面积平稳,所以选择30min作为萃取时间。
固相微萃取-气相色谱法测定软木塞及葡萄酒中超痕量2,4,6-三氯苯甲醚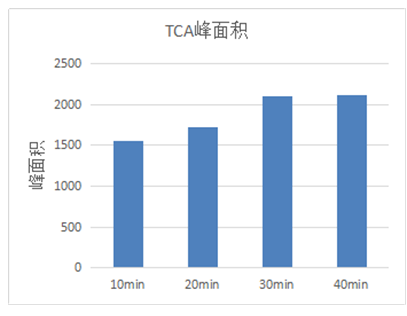
图3 萃取时间对萃取效果的影响
2.2 测定条件优化
采用程序升温对TCA色谱测定条件进行了优化,DCA及TCA与样品基质的干扰组分得到良好的分离见图1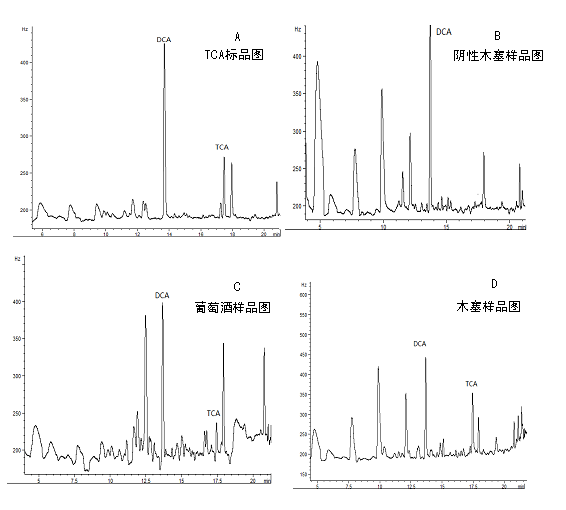
图1 TCA标准品及样品谱图
2.3 方法学评价
2.3.1 线性范围及检出限
分别配制2.0ng/L~50 ng/L 5个不同质量浓度的TCA种标准溶液,按上述确定的实验条件进行测定,质量浓度为横坐标,以TCA峰面积与DCA峰面积之比为纵坐标、绘制出测定曲线,线性回归方程y=18.947x,相关系数R2 =0.9989,信噪比大于10时,定量下限为0.60 ng/L。
2.3.2回收率的测定
在软木塞浸泡液及葡萄酒中加入不同浓度的TCA标准溶液,按照实验方法测定计算方法回收率,结果如表2,TCA的回收率在80.0%~113.75%之间,说明说明该法具有很好可靠性和准.确性。
表1 方法的加标回收率
| 样品 | 样品浓度(ng/L) | 加标量 (ng/L) | 测得回收量 (ng/L) | 回收率 (%) |
| 软木塞 | 2.2 | 4.0 | 3.7 | 92.50 |
| 8.0 | 9.1 | 113.75 | ||
| 葡萄酒 | 5.3 | 4.0 | 3.2 | 80.0 |
| 8.0 | 6.7 | 83.75 |
2.3.3重复性测定
取同一样品6份按照实验方法进行测定TCA含量,计算方法相对标准偏差,结果见表2,方法的重复性小于10%,说明此方法可靠,数据准确。
表2 方法重复性测定
| 测量次数 | 1 | 2 | 3 | 4 | 5 | 6 | 平均值 | RSD% |
| 测量值(ng/L) | 9.2 | 8.5 | 10.3 | 9.4 | 11.2 | 8.7 | 9.78 | 9.78 |
2.4 样品中TCA的测定
按照实验方法对本次测试3种个不同类型的橡木塞及7个葡萄酒样品,标品及样品的谱图样品结果如下表3:
表3 软木塞及葡萄酒中TCA检测结果 (ng/L)
| 聚合塞8# | 聚合塞2# | 聚合塞3# | 天然塞4# | 天然塞5# | 贴片塞6# | 贴片塞7# |
| 6.3 | 2.3 | 4.4 | ND | ND | 3.8 | 2.1 |
| 葡萄酒1# | 葡萄酒2# | 葡萄酒3# | 葡萄酒4# | 葡萄酒5# | 葡萄酒6# | 葡萄酒7# |
| 10.2 | 2.4 | 5.2 | 2.4 | ND | ND | ND |
注:ND表示未检测出
这3种木塞类型代表了国内葡萄酒高中低当葡萄酒的封装材料,由上表可以看出测试的原木塞没有检测出TCA,生产原木的原料控制的很好,原木经过消毒加工过程中也没有受到很多污染。1+1贴片塞检出了TCA,与 遭受污染跟使用的粘合剂,加工方式,以及碎木屑的种类以碎木屑的卫生状况有关;检测的7种葡萄酒中有4种检测出TCA,说明我国葡萄酒存在一定量的TCA污染。
3 结 论
建立了固相微萃取-气相色谱法测定软木塞及葡萄酒中超痕量2,4,6-三氯苯甲醚(TCA)的分析方法。对萃取温度、盐浓度及萃取时间等条件进行了优化。确定.佳条件:5ml样品,加入1.5g 氯化钠,萃取温度为40℃,40℃平衡10min,萃取时间30min。待测组分经过萃取富集后,气相色谱-电子捕获检测器检测,内标法进行定量。该方法在2.0~50.0ng/L范围内线性良好,定量限为0.6ng/L,回收率在 80.0 %113.75 %之间,相对标准偏差(n=5)小于10.0%,满足葡萄酒及软木塞中超痕量TCA测定的需要。
参考文献
[1] Prak S, Gunata Z, Guiraud J P, et al. Fungal strains isolated from cork stoppers and the formation of 2, 4, 6-trichloroanisole involved in the cork taint of wine[J]. Food microbiology, 2007,24(3):271-280.
[2] Tindale C R, Whitfield F B, Levingston S D, et al. Fungi isolated from packaging materials: Their role in the production of 2, 4, 6‐trichloroanisole[J]. Journal of the Science of Food and Agriculture, 1989,49(4):437-447.
[3] Andrewes P, Bendall J G, Davey G, et al. A musty flavour defect in calcium caseinate due to chemical tainting by 2, 4, 6-tribromophenol and 2, 4, 6-tribromoanisole[J]. International Dairy Journal, 2010,20(6):423-428.
[4] 赵英莲,牟德华,李艳. 顶空固相微萃取联合气相色谱-质谱检测葡萄酒中2,4,6-三氯苯甲醚[J]. 食品科学 , 2016,10:219-225.
[5] 刘卿,钟其顶,李敬光,固相微萃取-气相色谱-负化学源质谱法测定葡萄酒中2,4,6-三氯苯甲醚[J].卫生研究. 2012,04:642-645.
[6] 张素娟 超声波辅助-顶空固相微萃取-气相色谱法测定软木塞中痕量2,4,6-三氯苯甲醚[J].食品工程. 2015,02:38-40.
[7] Vlachos P, Kampioti A, Kornaros M, et al. Matrix effect during the application of a rapid method using HS-SPME followed by GC-ECD for the analysis of 2, 4, 6-TCA in wine and cork soaks[J]. Food chemistry, 2007,105(2):681-690.
[8] Henryk H. Jeleń,Mariusz Dziadas,Małgorzata Majcher. Different headspace solid phase microextraction – Gas chromatography/mass spectrometry approaches to haloanisoles analysis in wine[J]. Journal of Chromatography A, 2013:185-193. ASEIMEDLINEWA
[9] Ariel R. Fontana,Jorgelina C. Altamirano. Sensitive determination of 2,4,6-trichloroanisole in water samples by ultrasound assisted emulsification microextraction prior to gas chromatography–tandem mass spectrometry analysis[J]. Talanta , 2010,81(4):1536-1541.
[10] Isabel Márquez-Sillero,Soledad Cárdenas,Miguel Valcárcel. Headspace–multicapillary column–ion mobility
spectrometry for the direct analysis of 2,4,6-trichloroanisole in wine and cork samples[J]. Journal of Chromatography
A, 2012,1265:149-154 .
