经济高效的免疫荧光实验和长期样品存储的理想载玻片
时间:2021-06-18 阅读:1578
ibidi提供了一个简单经济高效的方案,使用可移除的12孔腔室载玻片进行细胞的培养,固定和染色。培养MCF-7细胞并用formalin溶液固定。细胞核用DAPI和肌动蛋白骨架用DYE-490鬼笔环肽染色。可以使用一抗和二抗染色通过免疫细胞化学探测其他细胞内结构。

德国ibidi 81201载玻片
实验使用的材料和试剂列于下面。
12孔腔室载玻片,可移除(ibidi,81201)
用于腔室的盖玻片,可移除,24mm x 60 mm(ibidi,10811)
细胞:MCF-7(CLS,300273)
细胞培养基
细胞培养试剂
聚苯硫醚
formalin溶液中性缓冲液,10%(Sigma,HT5011)
染色试剂
o DAPI(Sigma,D954)
o DYE-490鬼笔环肽(Dynomics,490-33)
安装介质:FluoroshieldTm值(Sigma,F6182)

实验方案:
步骤1:
必须在预实验中确定细胞系的正确接种浓度。根据您的细胞类型,用2-6x10 4细胞/ ml在2-3天内产生汇合的单层。
1.打开12孔可移除腔室载玻片(ibidi,81201)包装,在无菌条件下可拆除。
2.像往常一样用胰蛋白酶消化并计数细胞。细胞浓度为5×104细胞/ ml MCF-7。
3. 将250μl细胞悬浮液加入腔室的每个孔中。避免摇晃,因为这会导致细胞分布不均匀。
4. 用配套的盖子盖住。在37°C和5%CO2下培养。细胞至少培养24小时,或直到建立融合的单层
步骤2:
固定是染色程序的第一步。目标是将细胞,细胞形成物或组织维持在其当前状态,并在较长时间内通过化学试剂保存。
1.小心地吸出细胞培养基。
2.用PBS洗两次。
3.加入250μl的formalin溶液。
4.在室温下孵育30分钟。
5.小心吸入formalin溶液。
6.用PBS洗涤三次。
步骤3:
应根据感兴趣的细胞结构选择染色试剂。在该方案中使用DAPI和DYE-490鬼笔环肽染色MCF-7细胞的细胞核和肌动蛋白骨架。
1.准备你的染色溶液:· 聚苯硫醚· DYE-490鬼笔环肽· DAPI 1µg/ml
2.小心吸出PBS。
3.移取250μl染色溶液到每个孔中
4.在室温下避光孵育30分钟
步骤4:
在染色后清洗你的样本会使背景信号降到很低
1.小心地吸出染色溶液
2.加入250μl缓冲液
3.小心吸入缓冲液
4.重复步骤2和步骤3一次
步骤5:
从一个边部开始,用手或用镊子小心地取下硅胶垫圈。该步骤应以缓慢,稳定的进行,以避免损坏细胞层。
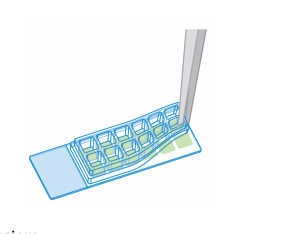
步骤6:
完成染色程序后,必须在用显微镜成像之前封固样品。该步骤还防止样品脱水。
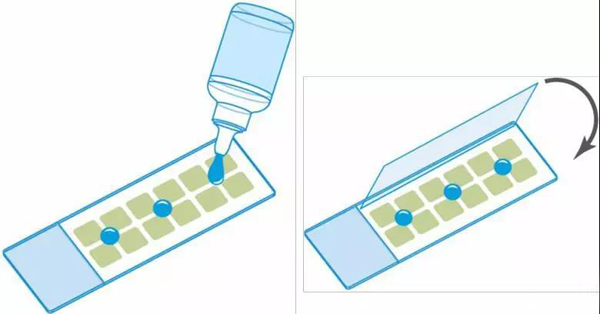
1.将载玻片侧面在干净的实验室湿巾上轻敲,从样品中去除多余的介质。
2.将封固剂涂在样品上。用24毫米x 60毫米的盖玻片覆盖安装的样品,小心地将盖玻片放到安装介质上,以避免夹住任何气泡。推荐使用诸如FluoroshieldTm值(Sigma-Aldrich),Vectashield®(Vector Laboratories Inc.)或ProLongAntifade®(ThermoFisher Scientific)的硬化封固剂。
3.安装封固剂固化。
步骤7:显微观察
使用12孔可移除载玻片培养MCF-7细胞,用DAPI和DYE 490鬼笔环肽染色细胞结构。使用硬化封固剂安装载玻片保存样品以便长期储存。
图1用DYE490鬼笔环肽(左上)染色MCF-7细胞的肌动蛋白骨架,并用DAPI(右上)染色细胞核。下图显示了合成图像,其中细胞核为蓝色,肌动蛋白骨骼为绿色。(比例尺:100μm)

