诺华CAR- T疗法今日获美国FDA优先审评资格
时间:2017-04-01 阅读:1396
3月29日,诺华宣布美国 FDA 已为其 CAR- T 疗法 CTL019(tisagenlecleucel-T)的生物制剂许可申请颁发了优先审评资格。这意味着诺华 CAR- T 生物制剂许可申请的审批流程有望得到进一步的缩减。
CTL019 zui初由宾夕法尼亚大学开发。2012 年,诺华与宾夕法尼亚大学达成合作协议,共同研究、开发与商业化包括 CTL019 在内的多项 CAR- T 疗法,用以癌症治疗。目前,CTL019 申请上市的适应症为儿童或年轻人中复发或难治性的急性 B 细胞型淋巴性白血病(B-cell acute lymphoblastic leukemia)

“在过去 5 年里,我们在癌症的个体化治疗上做出了大量努力,并在细胞工程的开发与应用上取得了巨大进展,” CAR- T 疗法之一,宾夕法尼亚大学的 Carl June 教授说道:“现在我们知道,它能在范围内的临床试验中治疗患者,我们观察到的试验结果也表明对于那些常规疗法不起作用的血液癌症来说,它有望成为一种新的治疗模式。”
在先前一项名为 ELIANA 的 2 期临床试验中,CTL019 取得了良好的疗效。一共有 50 名患者参与了这项临床试验,而在接受 CTL019 治疗的 3 个月后,高达 82% 的患者的症状出现了*缓解,或全血细胞计数不全的*缓解。治疗后,没有一名患者因“细胞因子风暴”(cytokine release syndrome)死亡。去年 12 月,这项研究也在美国血液学学会(American Society of Hematology)的大会上得到报道。
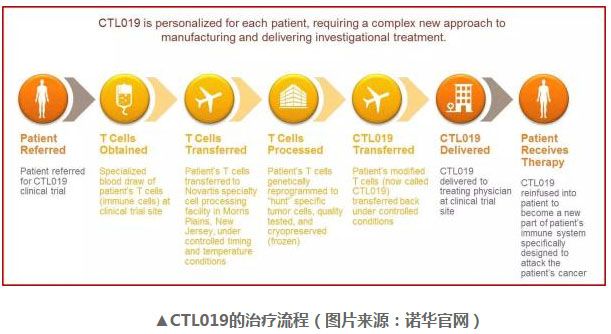
“CTL019 让诺华站在了免疫细胞疗法领域的科学与开发前沿,这是一种创新的疗法,用以治疗缺乏疗法的特定癌症,”诺华药物开发负责人兼医学官 Vas Narasimhan 博士说道:“CTL019 申请的接受与这项优先审评资格让我们离为这些患者送上这一创新疗法又更近了一步。”
