GST融合蛋白纯化磁珠 技术问答
时间:2018-05-22 阅读:4003
GST融合蛋白纯化篇
1.如何纯化GST融合蛋白?
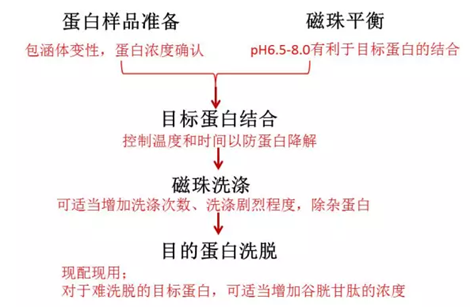
2.可纯化蛋白种类
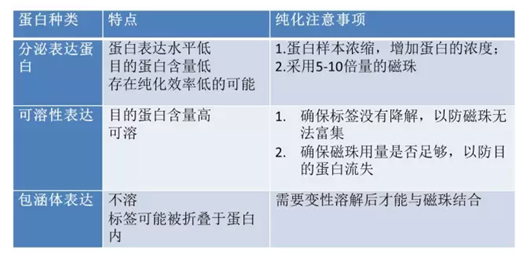
3.磁珠挂不上目的蛋白
以下的处理方案的前提是样本里面有目的蛋白,如果是包涵体需要变性。
可能一:结合条件不对
理想的结合条件为pH 6.5-8.0,纯化之前确认磁珠是否采用缓冲液平衡以及蛋白样本的pH值,低于pH6.5或高于pH8时,融合蛋白与磁珠结合不充分导致结合效率低。
可能二:样本中目的蛋白的浓度偏低
目的蛋白的浓度过低,会严重影响磁珠与蛋白的结合。
两种方法可供选择:
a)浓缩蛋白样本;b)增加磁珠的浓度
可能三:检查目的蛋白是否聚集沉淀
在细胞裂解前加入DTT,在缓冲液中也加入DTT 。1-20mM的DTT 会显著增加某些GST融合蛋白的结合。
可能四:判断是否是因为GST失活
过度超声会破坏标签蛋白而减少其与磁珠的结合。减少超声破碎的时间和强度。
可能五:标签蛋白可能改变了GST 构相
降低结合的温度来改善结果。
4.目的蛋白在磁珠上,洗脱不下来
*步:判断是否结合
取Mag beads加loading buffe煮沸,再跑page电泳。
如果确认有蛋白,且载量还很高,那么极有可能是形成了过蛋白沉积。
太多的蛋白沉积在磁珠孔内,无法洗脱。建议将目的蛋白样本稀释,少量纯化。
第二步:调节洗脱条件
洗脱缓冲液pH,酸性的都洗不下蛋白。尽量将洗脱液的pH值调到8.0。
5.洗脱样本里面有杂蛋白
可能一:非特异性吸附
提高平衡缓冲液中的盐浓度可以降低因为离子作用带来的非特异吸附。
在平衡缓冲液中添加0.5%吐温或Triton可以避免因为疏水相互作用导致非特异吸附,这些措施都可以电泳的杂带明显减少。
可能二:26KD的GST条带
GST融合蛋白的表达系统很容易表达到GST部分就终止,所以26KD左右的杂带是很常见的,那可以选择用不同浓度的还原谷胱甘肽去做阶段洗脱,如果还是分不开,那也许就得选择离子交换或者凝胶过滤等别的分离手段。
可能三:蛋白降解
如果用上述方法还是杂带多,那就地回头去看看破碎的条件是不是太剧烈或者温度控制不好导致蛋白短裂或者分解导致一些蛋白片段带标签,或者因为样品长时间保存导致水解等
可能四:蛋白相互作用
蛋白相互作用形成聚合体,导致杂带增加,而由于疏水相互作用或者因为离子作用可以通过添加表面活性剂或者增加离子强度得到改善,对于因为形成聚合体的可以在缓冲液和样品中加1-2mM巯基乙醇避免。
