Science特刊:一文读懂CAR-T细胞疗法进展
时间:2018-04-17 阅读:1419
| 导读 | 2017年是CAR-T疗法的元年,我们见证了两款CAR-T疗法的上市。日前,《科学》杂志推出了新兴的癌症免疫疗法的特刊,回顾这些领域所取得的成就。在今天的文章中,我们一起了解风头正盛的CAR-T细胞疗法。 |
本文转载自“药明康德”。
CAR-T细胞疗法属于过继性T细胞转移(adoptive T-cell transfer,ACT)的一种,这是输血医学的一个新领域,涉及淋巴细胞回输以实现抗肿瘤,抗病毒或抗炎作用。该领域从临床前研究到临床应用一直得到快速发展,去年我们见证了两款CAR-T细胞疗法的上市,用来治疗白血病和淋巴瘤。作为*款上市的CAR-T细胞产品Kymriah的主要研发人员,宾夕法尼亚大学的Carl June教授等人在的《科学》综述中,描述了目前CAR-T疗法要进入主流肿瘤学领域面临的机遇和挑战。

▲宾夕法尼亚大学Carl H June博士(图片来源:宾夕法尼亚大学)
1、TCR-T和CAR-T
目前,ACT癌症疗法主要有三种类型:肿瘤浸润淋巴细胞(TIL)、T细胞受体(TCR)T细胞和嵌合抗原受体(CAR)T细胞。TCR-T或CAR-T细胞是通过基因转移技术改造外周血T淋巴细胞而生成,CAR-T已经有产品获得FDA批准。TIL治疗的原理在多个临床试验中得以证实,显示出诱导转移性黑素瘤患者的持久*反应,其能够靶向黑色素瘤中的新抗原。针对这些不同形式的ACT,很多制药和生物技术公司正在进行研发和商业化。
TCR由在T细胞表面与CD3复合物非共价结合的a-和β-链组成。*种进入临床的TCR-T细胞癌症免疫疗法针对的适应症是转移性黑素瘤,使用TCR结合来自黑素细胞分化抗原的人淋巴细胞抗原A2(HLA-A2)肽。
随后,更高亲和力的TCR被开发出来,针对MART-1表位,通过降低MART-1表达来增强对癌细胞的识别。虽然这样获得了更高的缓解率,但会靶向表达在皮肤,眼睛和耳蜗的正常黑色素细胞。临床中超过一半的患者出现脱靶效应(on-target/off-tumor)毒性,提示靶向共同抗原会使得有效性和毒性之间往往只是差之毫厘。另外,靶向肿瘤睾丸抗原MAGE-A3的TCRs产生致死性神经毒性和心脏毒性,也对TCR的研发带来新的挑战。
然而,用表达对HLA-A2限制性肽特异性的TCR-T细胞靶向肿瘤睾丸抗原NY-ESO-1,获得临床有效的证据,而且没有显著的毒性。目前,工程化的NY-ESO-1 T细胞正在进行晚期临床试验 (NCT01343043),或许针对特定肿瘤新抗原的TCR会比靶向肿瘤共有抗原更安全。这一点还需要临床试验进一步证实。
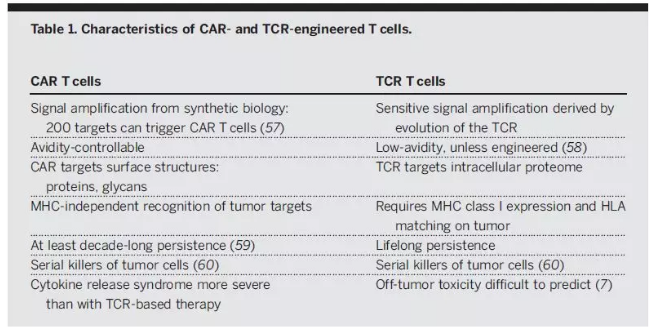
▲TCR-T和CAR-T细胞比较(图片来源:《科学》)
相比之下,CAR结合了抗原结合结构域(zui常见的是由抗体可变结构域衍生的单链可变片段(scFv)),TCRç链的信号结构域,以及受体(如CD28,OX40和CD137)的共刺激结构域。CAR克服了工程化TCR的某些局限性,例如需要MHC表达,MHC特性和共刺激信号。由Kuwana和Eshhar领导的小组表明了,这些类型的合成受体分子能够使T细胞识别MHC非依赖性靶标。与MHC限制无关的CAR识别,使CAR-T细胞具有显著的抗肿瘤优势,因为肿瘤免疫逃逸的主要机制之一就是肿瘤细胞MHC相关抗原提呈的丢失。目前CAR-T细胞的一个局限性是它们需要靶向肿瘤细胞表面上的抗原。
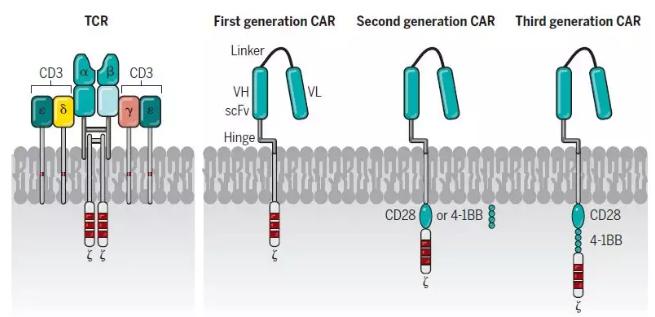
▲TCR-T和CAR-T细胞的构成(图片来源:《科学》)
2、在B细胞血液癌症上大获成功
事实上,使用*代CAR-T细胞疗法治疗多种癌症的临床试验结果不尽如人意。直到2011年,靶向CD19和编码共刺激区的第二代CAR-T细胞才成为癌症工程化T细胞治疗的主要范式。CD19的几个主要的特征使它成为了近乎理想的治疗靶点:在B细胞癌症中高表达,是人类正常B细胞发育所必需,而且不在B细胞谱系之外表达。
大多数复发性白血病患者在CD19特异性CAR-T细胞治疗后获得*缓解。但出现了两种形式的抗性。在急性白血病患者中,CD19抗原表位的缺失是肿瘤逃逸的主要机制。在针对青少年和小儿急性白血病患者的临床试验中,CD19表达阴性的患者复发率为28%。在慢性淋巴性白血病(CLL)中,尚无报道发现CD19缺失产生耐药,CLL的耐药性可能是由于细胞输注后CAR-T细胞不能增殖。表2列出了CAR-T细胞疗法在临床治疗中需要克服的几个重要挑战。

▲CAR-T细胞疗法面临的临床挑战和解决策略(图片来源:《科学》)
3、超越B细胞
目前,CAR-T技术已被证明除了靶向CD19之外还有更广泛的应用,针对靶点BCMA和CD22的CAR-T细胞在治疗多发性骨髓瘤和急性淋巴性白血病的早期临床试验中显示出抗肿瘤疗效。然而,BCMA和CD22与CD19一样,高度局限于在B细胞系上表达,因此只对特定组织有效。靶向实体瘤相关的抗原方面仍然没有太多进展。
ERBB2/HER2是肿瘤中过度表达的一种酪氨酸激酶受体,是许多抗体和ADC药物的有效靶标。但是,靶向ERBB2/HER2的CAR-T细胞治疗*例患者时产生了致命的毒性。跟多研究发现毒性是由于低密度表达ERBB2的肺上皮细胞也被CAR-T细胞识别和攻击,引发肺功能衰竭和大量细胞因子释放。因此,研究者采用更低剂量、更低亲和力的CAR- T细胞治疗肉瘤患者,结果显示是安全的,但临床效果有限。
另外,以碳酸酐酶IX(CAIX)抗原作为靶点的一代CAR-T细胞疗法在治疗肾细胞癌的1期临床试验中也意外产生肝毒性,原因是CAIX抗原在正常胆道上皮细胞也有低密度表达,但这在临床前研究中没有发现。以CEACAM5作为靶点的CAR-T细胞疗法在临床试验中,出现延迟的呼吸毒性,且与T细胞峰值扩展一致,表明癌症相关抗原潜在的on-target/off-tumor毒性。
靶向与实体瘤相关的其他共有抗原,如间皮素、癌胚抗原和GD2神经节苷脂的CAR-T疗法在临床试验中未发现明显的毒性;然而,这些试验中观察到的抗肿瘤活性也很弱。而具有增强的抗肿瘤活性的GD2特异性CAR-T细胞已经在临床前模型中发现会诱导致命的神经毒性。
另外,肿瘤微环境是ACT疗法成功应用的一大障碍,特别是在实体瘤中。包括免疫检查点(如PD-L1表达)、肿瘤代谢环境的改变(如缺氧或吲哚胺-1-氧化酶和精氨酸酶)、调节性T细胞以及抑制性骨髓细胞。在细胞治疗的过程中,这些免疫和代谢检查点在肿瘤中的表达都会升高,表现出适应性耐药。
目前,PD-1/PD-L1单抗与CD19 CAR-T细胞疗法组合的临床试验正在进行中(例如NCT02926833,NCT02650999和NCT02706405)。除了与检查点抑制剂的组合以外,研究人员还在研发阻断这些抑制通路的替代疗法,例如开关受体或基因编辑。
4、CAR-T疗法的毒性
接受ACT治疗后,T细胞活化会产生免疫刺激和炎症反应。目前,靶向CD19、BCMA和CD22的CAR-T细胞疗法都出现过严重的细胞因子释放综合征(CRS),比用TIL和TCR治疗出现的流感样综合征更加严重。CAR-T细胞疗法带来的CRS与肿瘤负荷相关。
此外,靶向CD19和BCMA的CAR-T细胞曾报道过意外神经系统并发症。其中CD19 CAR-T细胞疗法产生的神经毒性大部分可逆,但目前还不清楚脑水肿是CRS引起的还是另外有作用机制。目前,研究人员对于T细胞免疫疗法导致的CRS和脑水肿的机制仍不清楚。
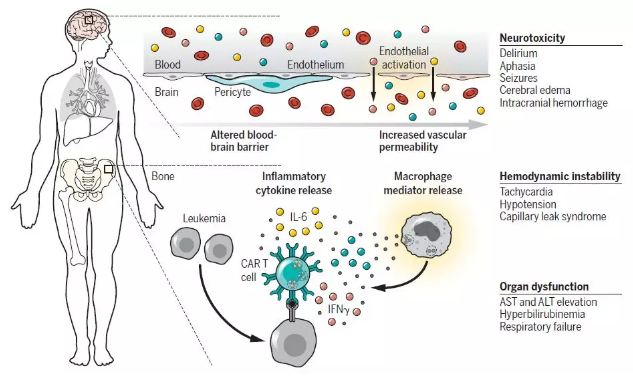
▲CAR-T细胞疗法的副作用:细胞因子释放综合症和神经毒性(图片来源:《科学》)
5、通用型CAR-T疗法
尽管ACT疗法属于异基因骨髓移植,但由于MHC的原因,ACT疗法目前仍集中在自体T细胞。如果可以消除MHC障碍,就能够实现同种异体T细胞治疗。与自体T细胞疗法相比,通用型CAR-T细胞来源于健康供体,有可能克服许多与癌症治疗相关的免疫缺陷;另外,通用型CAR-T细胞疗法的制造工艺更加简化,有望实现更快速、更便宜的“现成(off the shelf)”细胞疗法产品。
zui近,一项采用TALEN(转录激活因子效应物核酸酶)基因工程化改造的细胞在两名患者身上进行了试验,结果证明了现成的CD19 CAR-T细胞疗法的可行性。但基因通用型CAR-T细胞的移植在两个受试者中都受到限制,减弱了疗法的有效性。重要的是,受试者1的所有MHC I等位基因发生错配,导致了移植物抗宿主病。这意味着*的基因编辑对于该疗法的成功至关重要。另外,自然杀伤(NK)细胞对MHC I类缺陷细胞的识别也可能限制了移植。防止NK细胞溶解通用型CAR-T细胞的一种方法是插入HLA-E并删除HLA-A,-B和-C,这样可以阻止宿主T细胞杀死通用型CAR-T细胞。
由于该领域的快速发展,通用型CAR-T细胞可能得到广泛应用。然而,问题是它到底能作为单药疗法还是(例如干细胞移植或自体CAR-T细胞治疗的)辅助疗法。
6、基因编辑和多功能CARs
有许多基因编辑工具,包括锌指核酸酶(ZFNs),归巢核酸内切酶(meganucleases),TALENs和CRISPR-Cas9核酸酶。这些技术已经成功应用于工程化T细胞研究。现在该领域的主要问题是源自细菌的Cas9的免疫原性是否会影响CRISPR-Cas9基因编辑的T细胞的药物输送。
基因组编辑有可能用来解除CTLA-4和PD-1等免疫抑制信号,增强T细胞的功能,同时避免全面阻断免疫检查点分子带来的相关毒性。基因编辑也可以用于敲除T细胞表达的CAR靶点的基因,使得靶向不适用于T细胞免疫疗法的抗原成为可能。zui近,研究者将CAR引入TCR基因座,可以在内源性TCR启动子的条件下控制受体表达,从而显着增强CAR-T细胞功能。
为了减少与ACT的自身反应性免疫的潜在风险,研究人员已经开发了使基因工程T细胞诱导性死亡的合成分子系统,通常称为“自sha开关”。zui有名的方法是用促凋亡蛋白caspase-9与FKBP12(iCasp9)的结构域融合。在引入二聚体小分子例如利米德凝胶时,iCasp9的FKBP12结构域二聚化,使得T细胞经历快速凋亡性细胞死亡。在造血干细胞移植后的同种异体淋巴细胞输注中评估了iCasp9方法的试验,已经证实了强大T细胞消除能力,避免移植物抗宿主病。
7、CAR-T的推广之路
目前,有250多个关于CAR-T细胞的临床试验研究。其中,中国和美国是两大热门地区,欧洲、日本和南半球的临床试验数量要少得多。这与接受和投资新兴疗法的意愿,卫生监管政策以及社会差异都相关。
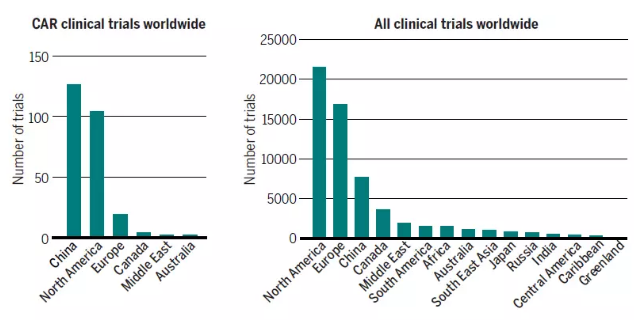
▲CAR-T细胞疗法临床试验的分布(图片来源:《科学》)
血液癌症患者,特别是CLL和多发性骨髓瘤患者接受有效、但不能治愈的疗法带来的经济负担也是一大挑战。CLL是美国zui常见的白血病形式,2000年约有100,000名患者,而且目前的疗法都只能改善生存状况,并不能治愈。因此给患者带来了巨大的经济负担。据估计,每名患者的终生治疗费用为604,000美元,到2025年,美国的CLL的医疗费用估计超过50亿美元/每年。
CAR-T细胞治疗可能比现有的标准疗法更具成本效益。目前高度个体化的T细胞疗法的工艺需要定制,由此带来高成本。但随着工艺的成熟,制造成本会有所下降。
8、未来机会与挑战
治疗白血病和淋巴瘤的CAR-T细胞疗法的出现值得关注,有多个方面的原因。也许zui重要的原因是,CAR-T是经美国FDA批准的*种获得推广的基因疗法。
目前,开发细胞疗法的zui大挑战之一是缺乏可以评估这些复杂疗法的安全性和有效性的临床前模型,或者是对早期临床研究中发现的安全问题的应对措施。另外,在治疗实体瘤方面仍然存在许多障碍。
值得期待的是,由于工程化T细胞、基因编辑和细胞制造领域的技术进步,未来基于T细胞的疗法有望扩大到其他细胞类型,如诱导多能干细胞、造血干细胞和NK细胞;适应症也会超越癌症,有望用于传染性疾病、器官yi植和自身免疫性疾病等各类疾病。
参考资料:
[1] CAR T cell immunotherapy for human cancer
