Nature(细胞死亡和疾病):一种p53异形体调节条件性细胞重编程
时间:2018-07-25 阅读:1369
肿瘤抑制蛋白p53是一种序列特异性转录因子,通过抑制或激活下游的靶基因来调节细胞增殖和凋亡。功能性p53的缺乏导致致瘤性转化, p53基因的突变也是目前人恶性肿瘤中常见的基因变异之一, 40多年来一直是肿瘤研究领域中重要和活跃的分子之一。近几年来,科学家们对p53的异形体越来越多。迄今为止,人们已鉴定出14种天然的p53异形体(isoform):p53α、p53β、p53γ、Δ40p53α、Δ40p53β、Δ40p53γ、Δ133p53α、Δ133p53β、Δ133p53γ、Δ160p53α、Δ160p53β、Δ160p53γ、Δp53和 p53ψ,而且其中的很多p53异形体能够导致不同的生物学表型。
尽管野生型全长p53的功能已得到很好的确定,但是各种p53异形体在衰老、生长率和凋亡中的生理作用以一种复杂的经常明显存在冲突的方式关联在一起。美国乔治城大学医学中心细胞重编程实验室主任、细胞永生化科学家,病理学系刘学锋(Xuefeng Liu)教授及其同事们之前已在体内和体外证实两种p53异形体---Δ133p53α和p53β---潜在地调节人细胞的增殖并可能调节细胞重编程。
在一项发表在Nature子刊(细胞死亡和疾病)的研究[1]中,刘学锋教授及其团队报道了一种以前未有见过报道的有关Δ133p53α新功能----调节条件性细胞重编程过程和端粒酶的活性。利用他们在2011年开发出的条件性重编程细胞(conditional reprogramming cell, CRC)技术对两种在体外培养时具有有限增殖寿命(replicative lifespan)的原代人细胞---从新生儿包皮中分离出的人包皮角化细胞(human foreskin keratinocyte, HFK)和从正常的成年人前列腺组织中分离出的人前列腺上皮细胞(human prostate epithelial cell, HPEC)---进行条件性重编程,结果证实Δ133p53α在这些条件性重编程的HFK和HPEC细胞中调节细胞增殖。过度表达Δ133p53α一致性地延缓细胞衰老并且让原代培养的HFK和HPEC细胞在一种Rho相关激酶(ROCK)抑制剂的存在下能够在体外无限地增殖(如图1所示)。这种Δ133p53α延长的细胞增殖寿命涉及上调hTERT表达和它的端粒酶活性。
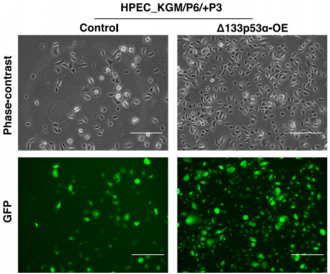
图1,图片来自Cell Death & Disease, Published online: 03 July 2018, doi:10.1038/s41419-018-0767-7.
鉴于这种CRC技术发挥的重要作用,那么到底什么是CRC技术呢?让我们先回顾一下这个领域的研究背景。
在此之前,绝大多数癌细胞系是利用高分级或转移性肿瘤建立的,而且其中的不少癌细胞系经证实与其来源的肿瘤存在遗传上的不同。大多数原代细胞系具有有限的增殖次数,终都因细胞衰老而具有有限的寿命。迄今为止,科学家们利用了多种方法来维持原代细胞的增殖能力。
一种可能是为常见的维持方法是利用病毒癌基因转化原代细胞。特别地,利用SV40大T抗原或致癌性人乳头瘤病毒E6/E7蛋白的编码基因加以转化能够导致很多类型的细胞永生化。但是,这种基因操纵导致基因组不稳定,因此在经过几次传代后,体外培养的转化细胞渐进性地积累着基因组变异,这就会导致它们具有不同于它们起源的原代细胞的表型,比如可能具有异常的p53和Rb调节通路。
另一种永生化方法让一些原代细胞表达人端粒酶逆转录酶亚基(hTERT)等外源性细胞基因就能够阻止它们的染色体变短,让它们逃避细胞衰老,从而导致永生化。尽管过度表达hTERT并不会导致正常的细胞发生癌变,但是所形成的细胞在经过多次传代后也表现出异常的细胞特性。
此外,通过导入外源性基因让皮肤细胞或血细胞等体细胞退回到一种类似于胚胎干细胞的状态,所形成的细胞被称作诱导性多能干细胞(iPS细胞)。这种ips细胞技术也能够延长细胞寿命,但是它的效率相对较低,而且导入外源性基因会诱导细胞基因组发生变化,甚至可能诱发肿瘤产生。
针对现有技术的这些缺点,2010年,刘学锋教授等人发现在体外利用ROCK抑制剂Y-27632处理三种人原代角化细胞---人新生儿包皮角化细胞、成年人阴道角化细胞和成年人子宫颈外角化细胞(ectocervical keratinocyte)---能够极大地增加这些在体外培养时具有有限寿命的人原代角化细胞的增殖能力,地导致它们永生化[2]。更重要的是,这些永生化细胞表现出典型的原代角化细胞特征,而且它们具有正常的二倍体核型和完整的DNA损伤反应,此外还能够经分化后产生复层上皮(stratified epithelium)。这有助于研究很多不同的皮肤上皮和黏膜上皮疾病的致病过程。
在此基础上,刘学锋教授等人在2011年底发现组合使用ROCK抑制剂Y-27632和经过照射的小鼠成纤维细胞(作为饲养细胞层)可诱导来自人体很多组织(比如前列腺和乳腺)的正常上皮细胞和肿瘤上皮细胞在体外无限地增殖,而无需导入外源性的病毒基因或细胞基因[3],如图2所示。在这种生长条件下,在5至6天内可从针刺活组织中培养出2 × 106个细胞,能够从低温保存的组织中培养出大量的细胞,而且还能够利用不到4个活细胞培养出大量的细胞。持续的细胞增殖依赖于饲养细胞和Y-27632,因此将这种组合使用产生的细胞称为条件性重编程细胞(conditionally reprogrammed cell, CRC)。此外,这些CRC细胞保持正常的二倍体核型,而且没有致癌性。这种CRC技术也适用于来自人类和啮齿类动物的肿瘤上皮细胞。
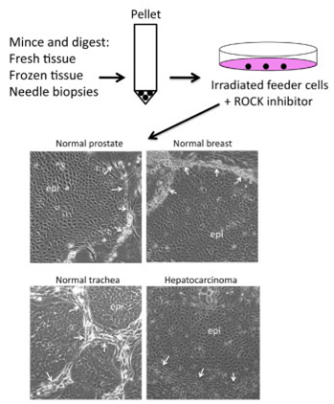
图2,图片来自The American Journal of Pathology, February 2012, doi:10.1016/j.ajpath.2011.10.036.
也正是这种CRC技术具有以上优点,它一经问世就引发人们的极大关注,并被*不少实验室采用。基于此,刘学锋教授等人在2017年将这种CRC技术的详细步骤发布在Nature Protocols期刊[4]上,供人们参考。
谈了这么多,那么CRC方法的作用机制什么呢?或者说,在这种方法中,作为饲养细胞的小鼠成纤维细胞和Y-27632到底起着什么作用呢?
针对这一点,美国耶鲁大学医学院的Seema Agarwal和David L. Rimm在一篇评论文章中进行了总结[5]。在这种CRC方法中,经过照射而没有增殖能力的成纤维细胞诱导和维持原代上皮细胞表达hTERT。这种影响很可能是通过细胞间的直接相互作用或者通过分泌可扩散的生长因子和细胞因子(比如IL-6、HGF和TGFβ等)加以实现的。它也可能是通过提供一种不可溶的胞外基质(ECM)或者通过分泌ECM重塑蛋白(比如MMP-9和MMP-3)加以调节的。
经过照射的非增殖性成纤维细胞分泌的生长因子、细胞因子和ECM重塑蛋白的不确定性组合似乎在维持与饲养细胞和Y-27632一起培养的原代上皮细胞的不受限制的增殖潜力中起着至关重要的作用。此外,另一个潜在地影响这种无限制增殖的变量是将小鼠成纤维细胞用作饲养细胞的事实。尽管这些小鼠成纤维细胞分泌的蛋白因子可能与人细胞产生的蛋白因子是相类似的,但非人细胞微环境对人原代上皮细胞的影响仍未得到充分理解。
这种CRC方法的另一个关键部分是使用一种ROCK抑制剂来协助维持原代上皮细胞的未分化状态和增殖状态。尽管这种ROCK抑制剂的使用不是新的,但是它与饲养细胞的组合使用似乎在阻止这些体外培养的细胞衰老方面起着关键性的作用。
为了验证这一点,刘学锋教授等人[3]通过对起源自正常的前列腺和乳腺组织的上皮细胞进行核型分析,证实它们仍然保持二倍体核型,而且当被注射到小鼠体内时,它们也不会产生肿瘤。因此,刘学锋教授等人[3]证实组合使用经过照射的小鼠成纤维细胞和这种ROCK抑制剂是它们的初期存活和无限制增殖所*的。移除两种组分中的任何一种都会导致所形成的CRC细胞分化,并终导致细胞衰老。
利用CRC技术实现的成体哺乳动物非角化细胞上皮细胞无限增殖也为基因疗法、细胞疗法、再生医疗和个性化医疗提供令人激动的机会。
比如,2012年,刘学锋教授等人利用CRC方法产生源自一名患者的正常肺部组织和肺部肿瘤组织的细胞培养物[6],其中这名患者患上20年的复发性呼吸道乳头瘤病,并且具有进行性的双侧肿瘤浸润肺实质。分析结果表明喉部肿瘤细胞含有一个长7.9kb的野生型人乳头瘤病毒11型(HPV-11)基因组,而肺部肿瘤细胞含有一个长10.4kb的HPV-11基因组。 肺部肿瘤细胞中的病毒基因组的大小增加是由于它的启动子和致癌基因区域发生复制。化学敏感性测试鉴定出伏立诺他(vorinostat)是一种潜在的治疗药物。在开始治疗3个月后,这名患者的肿瘤大小保持稳定,而且在15个月时,这种效果仍是持续性的。
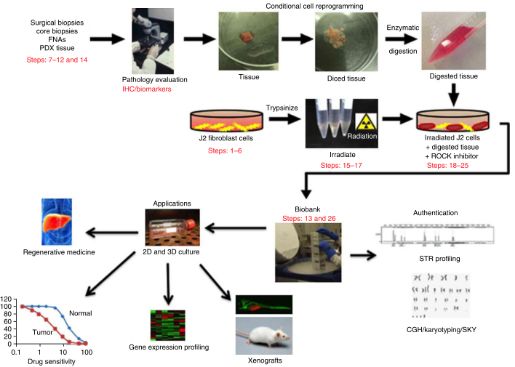
图3. CRC方法及其应用,图片来自Nature Protocols, 2017, doi:10.1038/nprot.2016.174。
总之,这种CRC方法具有快速地产生患者来源的原代细胞的巨大潜力,所产生的原代细胞可用于多种用途,包括构建活的生物库,探究基本肿瘤生物学特性,药物靶标识别和药物发现等,如图3所示。特别值得一提的是,今年4月美国国立卫生研究院(NIH)将CRC技术列为两种重要的人源癌症细胞模型之一 (7),作为接近患者的癌症生物学/医学/个体化治疗和新药发现工具之一, NCI执行所长James Doroshow是该项目的倡议和发起人。
参考文献:
1. Abdul M. Mondal, Hua Zhou, Izumi Horikawa et al. Δ133p53α, a natural p53 isoform, contributes to conditional reprogramming and long-term proliferation of primary epithelial cells. Cell Death & Disease, Published online: 03 July 2018, doi:10.1038/s41419-018-0767-7.
2. Sandra Chapman, Xuefeng Liu, Craig Meyers et al. Human keratinocytes are efficiently immortalized by a Rho kinase inhibitor. Journal of Clinical Investigation, July 2010, 120(7):2619-2626, doi:10.1172/JCI42297.
3. Xuefeng Liu, VirginieOry, Sandra Chapman et al. ROCK Inhibitor and Feeder Cells Induce the Conditional Reprogramming of Epithelial Cells. The American Journal of Pathology, February 2012, 180(2):599-607, doi:10.1016/j.ajpath.2011.10.036.
4. Xuefeng Liu, Ewa Krawczyk, Frank A Suprynowicz et al. Conditional reprogramming and long-term expansion of normal and tumor cells from human biospecimens. Nature Protocols, 2017, 12(2):439–451, doi:10.1038/nprot.2016.174.
5. Seema Agarwal, David L. Rimm. Making Every Cell Like HeLa: A Giant Step For Cell Culture. The American Journal of Pathology, February 2012, 180(2):443-445, doi:10.1016/j.ajpath.2011.12.001.
6. Hang Yuan, Scott Myers, Jingang Wang et al. Use of Reprogrammed Cells to Identify Therapy for Respiratory Papillomatosis.New England Journal of Medicine, 27 September 2012, 367(13):1220-1227, doi:10.1056/NEJMoa1203055.
