2018年7月Cell期刊不得不看的亮点研究
时间:2018-08-01 阅读:1615
2018年7月份即将结束了,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
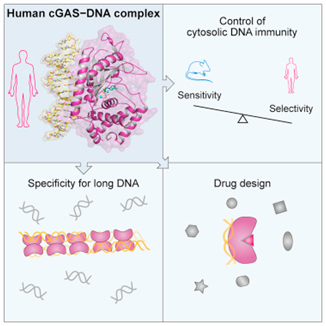
1.Cell:重磅!破解人cGAS的三维结构,揭示它为何识别长片段DNA同时忽略短片段DNA
doi:10.1016/j.cell.2018.06.026
人体是为生存而建造的。人体中的每一个细胞都受到一组免疫蛋白的严密保护,而且这些免疫蛋白装备了几乎*的雷达来检测外来的或受损的DNA。
图片来自Cell, doi:10.1016/j.cell.2018.06.010。
人细胞中的一个为关键的哨兵是一种被称作cGAS的“响应者”蛋白,它检测外来的和发生癌变的DNA的存在,并启动一种信号级联反应,从而触发身体防御。
2012年蛋白cGAS的发现引发了科学探究的风暴,迄今为止,科学家们已针对它发表了500多份研究出版物,但是人cGAS蛋白的结构和关键特征仍然困扰着科学家。
如今,在一项新的研究中,来自美国哈佛医学院和达纳-法伯癌症研究所的研究人员鉴定出人cGAS蛋白与其他哺乳动物中的GAS蛋白之间的结构差异和功能差异,并揭示出它在人体中发挥*功能的结构基础。这项研究概述了人cGAS蛋白的结构特征,这些结构特征解释了人cGAS为何和如何识别某些类型的DNA同时忽略其他类型的DNA。相关研究结果发表在2018年7月12日的Cell期刊上,论文标题为“Structure of the Human cGAS–DNA Complex Reveals Enhanced Control of Immune Surveillance”。
论文通信作者、哈佛医学院/达纳-法伯癌症研究所微生物学与免疫生物学助理教授Philip Kranzusch说,“人cGAS的结构和作用机制一直是免疫学和癌症生物学领域中的一个关键的缺失部分。我们的研究结果详细阐述了人cGAS的分子组成和功能,从而弥补了我们的知识中的这个重要的缺口。”
重要的是,这些研究结果能够为设计适合人cGAS蛋白的*结构特征的小分子药物提供了信息---这一进展有望改进当前作为抗癌疗法正在开发中的cGAS调节药物。
2.Cell:利用CRISPRi技术绘制人细胞中的基因相互作用图谱
doi:10.1016/j.cell.2018.06.010
在一项新的研究中,来自美国加州大学旧金山分校的研究人员使用一种基于CRISPR的高通量技术快速地绘制人细胞中将近500个基因的功能图谱,其中的许多基因之前从未被详细地研究过。相关研究结果于2018年7月19日在线发表在Cell期刊上,论文标题为“Mapping the Genetic Landscape of Human Cells”。
这项研究产生了大量新的遗传数据,包括鉴定出参与细胞能量产生的新基因,并解释了为何一些胆固醇药物可用于治疗骨质疏松症而相关药物没有这种效果的长期谜团。但是,这些研究人员说,一个为重要的研究结果就是这项研究展示了一个用于绘制人细胞中基因功能的新框架,而且他们希望这终扩展到整个人类基因组。
在这项新研究中,Horlbeck及其同事门对之前的实验中揭示的与细胞生长和存活相关的472个基因进行了基因相互作用图谱分析。为此,他们使用了一种被称作CRISPR抑制(CRISPR inhibition, CRISPRi)的工具。CRISPRi是CRISPR基因编辑系统的一个改进版本,能够在不编辑DNA本身的情况下降低基因活性。CRISPRi是Weissman实验室在2013年开发出来用于哺乳动物细胞中的,而且2016年,Weissman实验室利用它破解非编码RNA分子的功能(Science, doi:10.1126/science.aah7111)。
这些研究人员利用CRISPRi系统性地让两种不同白血病细胞系中的成对基因---一种细胞系代表急性淋巴细胞白血病(ALL)和另一种细胞系代表慢性髓性白血病(CML)---灭活,同时测量对细胞生长的影响。由此产生的111628个*的双基因相互作用图谱允许这些研究人员根据它们彼此之间的关系将472个基因分为不同的基因簇,并为这些基因簇分配功能意义,比如特定的生物通路或在细胞内的位置。
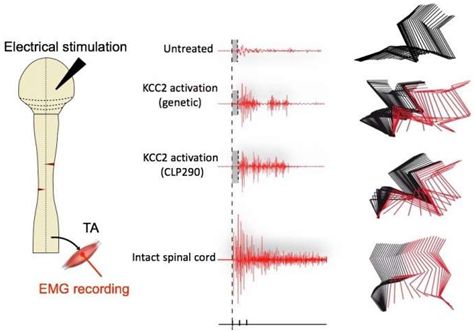
3.Cell:脊髓损伤治疗取得重大进展!利用小分子化合物重新激活脊髓回路
doi:10.1016/j.cell.2018.06.005
大多数脊髓损伤患者从损伤部位以下都瘫痪掉,即便脊髓并没有被*切断,也是如此。为什么脊髓中保持完好的部分不能继续发挥作用?如今,在一项新的研究中,来自中国南通大学、美国波士顿儿童医院和布莱根妇女医院的研究人员对脊髓中的神经回路(即脊髓回路)为何保持抑制状态提供了新的认识。他们还证实当全身给药时,一种小分子化合物能够激活瘫痪的小鼠中的这些神经回路,从而恢复它们的行走能力。相关研究结果于2018年7月19日在线发表在Cell期刊上,论文标题为“Reactivation of Dormant Relay Pathways in Injured Spinal Cord by KCC2 Manipulations”。论文通信作者为南通大学的顾晓松(Xiaosong Gu)教授和波士顿儿童医院的Zhigang He博士。
许多试图修复脊髓损伤的动物研究都集中在让神经纤维或轴突再生,或者让新的轴突从健康的轴突中出芽(sprouting)。虽然He的实验室和其他人之前已实现了令人印象深刻的轴突再生和出芽,但是在遭受严重的脊髓损伤后,这对动物运动功能的影响仍然是不那么清楚的。一些研究已尝试着使用5-羟色胺类药物等神经调节剂来刺激脊髓中的神经回路,但是这仅导致短暂的不受控制的肢体运动。
图片来自Zhigang He Lab, Boston Children's Hospital。
在这项新的研究中,这些研究人员采取了另一种方法,它受到基于硬膜外电刺激(epidural electrical stimulation)的策略取得成功的启发,这种策略也是仅有的一种对脊髓损伤患者有效的治疗方法。在这种治疗中,会将电流施加到脊髓的下部;通过结合康复训练,这能够让一些患者恢复运动。
这些研究人员选择了一些已知可改变神经元兴奋性并且能够穿过血脑屏障的化合物。他们将每种化合物腹膜内注射到每组小鼠(以10只小鼠为一组)中的瘫痪小鼠体内。所有小鼠都遭受严重的脊髓损伤,但都有一些神经保持完好无损。每组小鼠(再加上一个接受安慰剂治疗的小鼠对照组)接受治疗8至10周。
一种被称作CLP290的化合物表现出很强的效果,让瘫痪小鼠在治疗四至五周后能够恢复行走能力。肌电图记录显示瘫痪小鼠中两组相关的后肢肌肉活跃地运动。在停止治疗长达两周后,这些小鼠的行走分数仍然高于对照组。
已知CLP290激活在细胞膜中发现的一种被称作KCC2的蛋白,这种蛋白将氯离子从神经元中转运出去。这项新的研究表明受损脊髓中的抑制性神经元对运动功能的恢复是至关重要的。在脊髓遭受损伤后,这些神经元产生的KCC2显著减少。因此,这些研究人员发现它们无法正确地对来自大脑的信号作出反应。因不能够处理抑制性信号,它们仅对告诉它们持续放电的激励信号作出反应。而且鉴于这些神经元的信号是抑制性的,因此结果就是在整个脊髓回路中产生过多的抑制性信号。实际上,大脑告诉四肢移动的命令不会被传递。
通过使用CLP290或遗传技术恢复KCC2表达,这些抑制性神经元能够再次接收来自大脑的抑制性信号,因此它们更少地放电。这些研究人员发现,这会使脊髓回路转向激发,从而使得它对来自大脑的输入信号更加敏感。这就产生了让因脊髓损伤而失去功能的脊髓回路复活的效果。
4.两篇Cell发现噬菌体抱团抑制细菌CRISPR免疫系统,有助改进噬菌体疗法
doi:10.1016/j.cell.2018.06.013; doi:10.1016/j.cell.2018.05.058
CRISPR是规律间隔性成簇短回文重复序列(clustered regularly interspaced short palindromic repeats)的简称。它是旨在抵御外来DNA的细菌免疫系统的一个重要的组成部分。在细菌中,CRISPR的作用就像在人体细胞中的一把剪刀一样,切割外来的DNA链。尽管科学家们已知道CRISPR在野外大约一半的细菌中发现到,但他们对CRISPR与入侵的病毒或噬菌体之间的分子战争知之甚少。
在2018年7月19日同时在线发表在Cell期刊上的两篇论文中,来自两个研究团队的研究人员提供了当入侵含有CRISPR的细菌时,噬菌体彼此间进行合作的证据。他们发现为了压制CRISPR的破坏,噬菌体通过联合起来快速地感染细菌来加以适应,而且有时一个噬菌体还会为此作为引火噬菌体(primer phage)牺牲自我。这两个研究团队---来自美国加州大学旧金山分校和英格兰埃克塞特大学----着重关注细菌和噬菌体之间基于CRISPR和抗CRISPR蛋白(anti-CRISPR protein)的免疫关系。这两篇论文的标题为“Bacteriophage Cooperation Suppresses CRISPR-Cas3 and Cas9 Immunity”和“Anti-CRISPR Phages Cooperate to Overcome CRISPR-Cas Immunity”。
5.Cell:震惊!小小的海葵竟有100多种细胞类型
doi:10.1016/j.cell.2018.05.019
海葵为人们提供一种的模型,不过可能仅有的一点不足之处就是它有刺人的触须。它是一种易于保存在实验室中的小型海洋无脊椎动物,它的基因组是非常简单的,而且与人类的基因组存在着类似性。
尽管海葵(Nematostella vectensis)看起来简单,它的管状身体上有触须,但是它实际上是一种高度复杂的生物。在一项新的研究中,来自法国国家科学研究中心(CNRS)和巴斯德研究所的研究人员在这种小型海洋无脊椎动物中发现了100多种细胞类型和令人难以置信的神经元多样性。他们是在构建这种动物的细胞图谱时揭示出这种令人吃惊的复杂性。相关研究结果近期发表在Cell期刊上,论文标题为“Cnidarian Cell Type Diversity and Regulation Revealed by Whole-Organism Single-Cell RNA-Seq”。
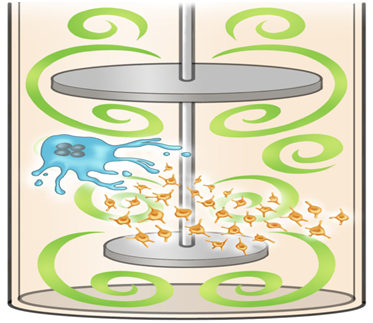
6.Cell:在湍流环境下,利用人诱导性多能干细胞大规模产生1000亿个血小板
doi:10.1016/j.cell.2018.06.011
人诱导性多能干细胞(human induced pluripotent stem cell, hiPSC)提供了一种可持续地产生足够数量的血小板用于输注的方法。这种方法涉及将从人类供者体内获取的血细胞或皮肤细胞在进行表观遗传学重编程后进入胚胎干细胞样状态,然后将这些未成熟细胞转化为在身体不同部位发现的特化细胞类型。然而,在此之前利用源自hipsC的巨核细胞产生血小板的尝试未能达到适合临床制造的规模。
为了解决这个问题,日本京都大学iPS细胞研究与应用中心的Koji Eto及其团队注意到在培养瓶中旋转时,源自hiPSC的巨核细胞产生的血小板数量要比在培养皿中的静态条件下的多。这一观察结果提示着来自水平摇动的物理应力促进血小板产生。在这一发现之后,Eto团队在一种带有一个流动腔室和多个支柱的新型微流体系统中测试了一种基于摇摆袋的生物反应器,然而,当采用这些装置时,每个源自hipsC的巨核细胞产生少于20个的血小板。
图片来自Misaki Ouchida/Kyoto University。
为了研究产生血小板的理想物理条件,在一项新的研究中,Eto和他的团队接下来对小鼠骨髓---产生血液组分的组织---进行了实时成像研究。这些实验表明巨核细胞仅当暴露于湍流血流时才会产生血小板。为了验证这一想法,模拟结果表明他们之前测试过的生物反应器和微流体系统缺乏足够的湍流能量。相关研究结果于2018年7月12日在线发表在Cell期刊上,论文标题为“Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production”。
在对各种设备进行全面测试后,这些研究人员发现使用一种被称作VerMES的生物反应器可以大规模地产生高质量的血小板。这种系统由两个椭圆形的水平定向的混合叶片组成,这两个混合叶片通过在气缸中上下移动产生相对高水平的湍流。由于这种叶片运动产生的湍流能量水平和剪切应力,由hipsC产生的巨核细胞产生了1000亿个血小板---足以满足临床需求。
在两种血小板减少症动物模型中开展的输注实验表明这些血小板在功能上类似于与人类捐献的血小板。具体而言,在兔子的耳朵静脉上产生切口和对小鼠的尾动脉进行穿刺后,这两种类型的血小板都相当程度地促进血液凝固和降低出血时间。
7.Cell:新型小分子药物可部分恢复遗传性耳聋小鼠的听力
doi:10.1016/j.cell.2018.06.004
十年前,美国国家卫生研究院(NIH)下属的国家耳聋与其他交流障碍研究所(National Institute on Deafness and Other Communication Disorders, NIDCD)的Thomas B. Friedman博士和Robert J. Morell博士及其团队分析了一个被称作LMG2的大家族的成员的基因组。耳聋是LMG2家族的一个遗传上的显性特征,这意味着一个孩子仅从父母那里继承一个有缺陷的基因拷贝就会经历进行性听力丧失。他们确定导致耳聋的突变位于4号染色体上的一个被称作DFNA27的区域,也因此这种耳聋被称作DFNA27型耳聋。这个区域含有十几个基因。然而,这种突变的位置一直是未知的。
解释这种DFNA27型进行性耳聋的一个关键分子线索来自于美国爱荷华大学的Botond Banfi博士和Yoko Nakano博士随后对小鼠RE1沉默转录因子(RE1 Silencing Transcription Factor, Rest)基因的研究。他们发现小鼠Rest基因在内耳的感觉毛细胞中通过一种不同寻常的机制受到调节,而且这种调节对小鼠的听力是至关重要的。
在一项新的研究中,鉴于小鼠Rest基因的人类版本位于DFNA27区域,美国国家耳聋与其他交流障碍研究所(NIDCD)和爱荷华大学的研究人员合作,重新探究了DFNA27型进行性耳聋之谜。
大多数之前的研究都忽视了Rest基因中的第4外显子,这是因为这个小的外显子没有被编辑到大多数细胞的Rest mRNA中。REST蛋白的正常功能是关闭仅在少数细胞类型中有活性的基因。
当Banfi团队剔除小鼠Rest基因的第4外显子时,内耳毛细胞死掉了,而且小鼠就耳聋了。很多应当是有活性的基因在内耳毛细胞当中被关闭了,因而它们就死掉了。Friedman团队和Banfi团队通过合作地查明了LMG2家族中的这种导致耳聋的突变所在的位置。他们发现这种突变位于第4外显子附近,改变第4外显子的边界,从而干扰内耳毛细胞中的Rest失活。相关研究结果于2018年6月28日在线发表在Cell期刊上,论文标题为“Defects in the Alternative Splicing-Dependent Regulation of REST Cause Deafness”。
Banfi说,“我们发现将第4外显子整合到REST mRNA后,它就在内耳的感觉毛细胞中起着一种开关的作用。它关闭REST,并且允许很多基因开启。其中的一些开启的基因在这些毛细胞存活和听力中起着重要的作用。”
这些研究人员使用Banfi培育出的缺乏REST第4外显子的小鼠作为DFNA27型进行性耳聋的模型。鉴于REST通过一种被称作组蛋白去乙酰化的过程抑制基因表达,他们想观察一下阻断这一过程是否可能降低听力丧失。通过使用抑制这一过程的小分子药物,他们能够关闭REST,并且部分地恢复这些小鼠的听力。
8.Cell:可视化观察流感病毒入侵靶细胞过程
doi:10.1016/j.cell.2018.05.050
几十年来,流感病毒一直是通过一种相同的机制入侵细胞的一大类病毒的研究模型:这些病毒表面上的包膜蛋白必须将它们附着到细胞膜上,随后它们与细胞融合在一起。这种融合让病毒的内含物释放到细胞中,因此它就能够接管细胞的内部功能并进行增殖。流感病毒的包膜蛋白HA长期以来一直是研究其他病毒中的融合机制的模板。
在一项新的研究中,来自美国塔夫茨大学医学院、西奈山伊坎医学院、德国图宾根大学和美因茨大学的研究人员直接地可视化观察流感病毒的表面蛋白发生的实时结构变化,这些变化可能有助这种病毒与靶细胞融合,入侵它们的内部并劫持它们的功能。他们发现位于流感病毒表面上的单个血凝素(hemagglutinin, HA)分子解折叠并向靶细胞延伸,随后重新折叠,这个过程每秒会发生5至10次。这一发现表明流感病毒要比之前认为的发生更大的动态变化,这可能有助于开发更加有效的疫苗和更好地理解埃博拉病毒、HIV和非典型肺炎冠状病毒(SARS-CoV)等其他的病毒。相关研究结果于2018年6月28日在线发表在Cell期刊上,论文标题为“Direct Visualization of the Conformational Dynamics of Single Influenza Hemagglutinin Trimers”。论文通信作者为塔夫茨大学医学院的James Munro博士和Dibyendu Kumar Das博士。
9.Cell:可视化观察视觉信息从视网膜到大脑中的单向传播
doi:10.1016/j.cell.2018.04.041
据估计,大多数人的大脑有860亿个神经元,它们终能够与任何其他的一个神经元进行双向交谈。在一项新的研究中,为了更好地了解这个迷宫般的神经网络中的神经元如何整合信息,即多个神经元如何发送和整合它们的信息到靶神经元中,来自美国贝斯以色列女执事医疗中心和波士顿儿童医院的研究人员着重关注一个罕见的情形,即信息仅沿着一个方向传播,即从视网膜到大脑传播。
这些研究人员开发出一种追踪当视网膜神经元的远末端---被称作终末扣(terminal bouton)---运送视觉信息到丘脑中时这些终末扣的活性的方法,其中丘脑是一个参与图像处理的大脑区域。相关研究结果发表在2018年5月31日的Cell期刊上,论文标题为“A Fine-Scale Functional Logic to Convergence from Retina to Thalamus”。论文通信作者为贝斯以色列女执事医疗中心的Mark Andermann博士和波士顿儿童医院的Chinfei Chen博士。
当它们将不连续的视觉信息传递到大脑时,不同类型的视网膜神经元对视觉内容的不同特征(比如物体的运动方向、亮度或大小)作出反应。人们普遍认为这些信息在丘脑中仍然是分开的。然而,这些研究人员发现来自不同类型视网膜神经元的终末扣经常被组装到局部簇中,而且局部簇中的终末扣通常与一个共同的靶神经元进行接触,这就导致不同的信息混合在一起。然而,这种混合并不是随机的---局部簇中的终末扣往往对一个或多个视觉特征具有相同的敏感性。
10.Cell:新系统可用于鉴定更多潜在酶类药物靶点
doi:10.1016/j.cell.2018.06.030
根据近的一项研究成果,一种新的药物发现系统能够帮助科学家们特异性地靶向一类特殊的酶类家族蛋白—“磷酸酶”。此前该类蛋白还没有合适的靶向药物。
来自MRC的科学家们证明这种新的系统能够鉴定得到一类磷酸酶靶向药物,从而降低亨廷顿症相关蛋白在小鼠脑部的累积。这一发现发表在近一期的《Cell》杂志上,该发现使得研究者们能够筛选靶向磷酸酶的药物分子。磷酸酶是一类特殊的酶,它参与调节信号通路的开启与关闭。
在这项研究中,作者将合成的磷酸酶镶嵌在微芯片上,因此能够快速进行筛选。在细胞水平鉴定其安全性后,将在小鼠水平进行研究。之后,研究者们利用该系统找到了一种靶向亨廷顿症的分子。包括亨廷顿症在内的许多神经退行性疾病,都存在错误折叠的蛋白质在大脑中累积的现象。研究者们希望通过抑制磷酸酶的活性能够降低细胞产生这种错误折叠蛋白质的程度。
在这项研究中,作者靶向的磷酸酶叫做PPP1R15B,而利用这种新型的药物发现平台发现的靶向性分子叫做Raphin1,能够特异性的识别上述磷酸酶。(生物谷 )
