碱基编辑器研究进展
时间:2018-11-01 阅读:1907
在广泛使用的CRISPR/Cas9基因编辑工具中,核酸酶Cas9含有两个具有切割活性的结构域:HNH结构域和RuvC结构域,其中HNH结构域切割与crRNA互补的DNA链,而RuvC结构域切割非互补链。RuvC结构域可分为三个亚结构域:RuvC I、RuvC II和RuvC III,RuvC I接近于Cas9的氨基端,RuvC II和RuvC III位于HNH结构域的两侧。仅对Cas9中的RuvC I进行突变,具体而言就是让RuvC I的两个关键氨基酸残基中的一个转换成丙氨酸(D10A或H840A),从而得到Cas9切口酶(Cas9 nickase, Cas9n)。这种切口酶不能切割非互补DNA链,仅能切割与crRNA互补的DNA链。如果同时让Cas9中的这两个结构域发生突变,便可得到仅对DNA有结合活性但没有切割活性的dCas9(nuclease-dead Cas9,没有核酸酶切割活性的Cas9)。
CRISPR/Cas9是由一种原始的细菌免疫系统改编而成的,它的作用方式是首先在基因组的一个靶位点上切割双链DNA。相比之下,碱基编辑并不切割DNA双螺旋,而是在组成DNA或RNA的四个碱基中,利用酶地重新排列其中的一个碱基上的一些原子,从而将这个碱基转化为一个不同的碱基,同时不改变其周围的碱基。这种能力大大增加了改变遗传物质的选择手段。2017年,通过碱基编辑器编辑技单个碱基技术入选2017年《科学》杂志“科学突破”。
1.Nat Med:碱基编辑器取得重大进展!有望在产前治疗先天性疾病
doi:10.1038/s41591-018-0184-6; doi:10.1038/s41591-018-0215-3
来自美国费城儿童医院和宾夕法尼亚大学佩雷尔曼医学院的研究人员进行产前基因编辑来阻止实验室动物出现致命性的代谢障碍,从而有潜力在出生前治疗人类先天性疾病。这就为在产前利用一种复杂的低毒的工具地对致病性基因中的DNA碱基进行编辑提供了概念验证。相关研究结果发表在2018年10月的Nature Medicine期刊上,论文标题为“In utero CRISPR-mediated therapeutic editing of metabolic genes”。论文通信作者为宾夕法尼亚大学佩雷尔曼医学院的Kiran Musunuru博士 和William H. Peranteau博士。
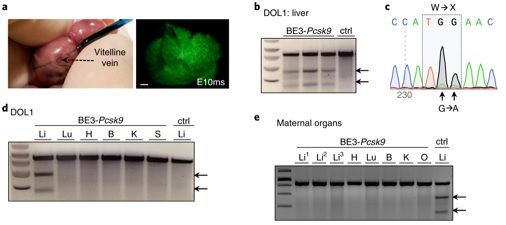
图片来自Nature Medicine, doi:10.1038/s41591-018-0184-6。
这些研究人员使用了基因编辑工具CRISPR-Cas9和第三代碱基编辑器(base editor 3, BE3)靶向编辑一种调节胆固醇水平的基因,从而降低了在子宫内接受过这种治疗的健康小鼠中的胆固醇水平。他们还在一小部分事先经过基因改造而携带着导致一种致命性肝脏疾病---1型遗传性酪氨酸血症(hereditary tyrosinemia type 1, HT1)---的突变的小鼠中使用产前基因编辑来改善它们的肝脏功能和阻止新生小鼠死亡。
2.Nat Med:在体内利用新型碱基编辑器有望治疗遗传疾病
doi:10.1038/s41591-018-0209-1; doi:10.1038/s41591-018-0215-3
苯丙酮尿症(phenylketonuria)的病因是编码苯丙氨酸羟化酶(phenylalanine hydroxylase, Pah)的基因发生突变。这种由肝细胞产生的酶代谢苯丙氨酸。这种代谢障碍是一种“常染色体隐性”遗传疾病:儿童如果从母亲那里遗传一个突变基因拷贝和从父亲那里遗传一个突变基因拷贝,那么就会患上这种疾病。到目前为止,这种疾病仍然是无法治愈的。
在一项研究中,来自瑞士苏黎世联邦理工学院和苏黎世大学的研究人员利用一种方法纠正肝细胞中的两个突变基因拷贝,从而治愈这种疾病。他们在小鼠体内取得了成功,。相关研究结果发表在2018年10月的Nature Medicine期刊上,论文标题为“Treatment of a metabolic liver disease by in vivo genome base editing in adult mice”。论文通信作者为苏黎世联邦理工学院的Gerald Schwank教授。
这种由胞苷脱氨酶(cytidine deaminase)加以强化的CRISPR/Cas9系统结合到这两个需要被校正的基因拷贝上,并且在局部打开DNA双链。胞苷脱氨酶将致病性的DNA碱基对C-G转化为健康人体内对应基因组位点上存在的碱基对T-A。这能够校正Pah酶编码基因中的DNA碱基错误。通过这种方法,这些研究人员改变了成年小鼠中这两个突变基因拷贝中的碱基序列。这些经过校正的肝细胞能够产生功能性的Pah酶,这些小鼠所患的这种疾病被治愈了。
3.Cell子刊:我国科学家成功利用碱基编辑修复人胚胎中的致病性基因突变
doi:10.1016/j.ymthe.2018.08.007
来自中国广州医科大学附属第三医院、中科院生物化学与细胞生物学研究所和上海科技大学的研究人员利用一种改进形式的CRISPR基因编辑技术来修复活的人胚胎中的遗传缺陷。在近期发表Molecular Therapy期刊上的标题为“Correction of the Marfan Syndrome Pathogenic FBN1 Mutation by Base Editing in Human Cells and Heterozygous Embryos”的论文中,描述了他们的研究工作和取得的进展。论文通信作者为广州医科大学附属第三医院生殖医学中心的刘见桥(Jianqiao Liu)教授和中科院生物化学与细胞生物学研究所的黄行许(Xingxu Huang)教授。
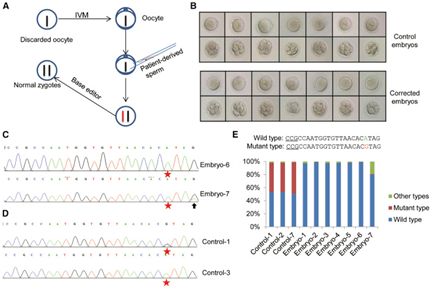
图片来自Molecular Therapy, doi:10.1016/j.ymthe.2018.08.007。
在三年前,一个中国研究团队利用CRISPR对人胚胎进行编辑。该团队试图利用这项技术修复人胚胎中的遗传缺陷。虽然这在当时成为世界各地的头条新闻,但是它的成功率很低---在经过这种技术编辑后存活下来的54个胚胎中,仅4个胚胎携带着成功得到修复的基 因。从那时起,人们就开发出一种新的被称作碱基编辑的CRISPR变体,它以更有效的方式发挥作用。这种新方法不会切断DNA链和利用携带着所需特征的DNA片段替换移除的DNA片段,而是仅仅改变DNA碱基---比如利用碱基G替换碱基A。在这项新的研究中,这些研究人员使 用这种新方法来校正导致人类患有马凡综合症(Marfan syndrome)的基因突变,在这种疾病中,患者在FBN1基因上发生G→A突变。这是一种导致结缔组织问题的疾病,而且给那些出生时就携带这种突变的人带来无数的问题。
他们对18个胚胎进行了基因编辑,并且在所有的这些胚胎中,事先设计好的碱基变换按照计划发生。但是,在两个胚胎中,其他的碱基也在无意中发生变换。他们声称他们的研究为这种碱基编辑技术提供概念验证---在现实世界的体外受精诊所中,有缺 陷的胚胎经发现后会被丢弃。然而,他们确实承认这个领域仍然是非常新的,而且在尝试将这种技术用于允许发育成胎儿的胚胎中之前,还需开展更多的研究工作。
4.两篇Protein & Cell报道我国科学家进一步优化腺嘌呤碱基编辑系统
doi:10.1007/s13238-018-0568-x; doi:10.1007/s13238-018-0566-z
来自中国华东师范大学和中山大学的两个研究小组在小鼠和大鼠品系中开发出一种被称作腺嘌呤碱基编辑器(adenine base editor, ABE)的碱基编辑系统,并对这种系统加以改进,这将对人类遗传疾病和基因疗法带来重大的影响。相关研究结果发 表在开放存取的Protein & Cell期刊上,论文标题分别为“Increasing targeting scope of adenosine base editors in mouse and rat embryos through fusion of TadA deaminase with Cas9 variants”和“Effective and precise adenine base editing in mouse zygotes”。
人基因由碱基A、T、C和G组成,这些碱基以特定的顺序排列在一起来编码遗传信息。这种ABE系统能够产生所需的A→G转化,因而允许科学家们改变遗传密码,同时让不想要的结果zui小化。鉴于几乎一半的人类遗传疾病是由C/G→T/C突变引起的,这是通过ABE系统加 以校正,因此它是一种有前景的治疗应用技术。
在这两项新的研究中,这些研究人员利用这种ABE系统地培育出三种小鼠品系来模拟一种被称作杜氏肌营养不良(Dunchenne Muscular Dystrophy, DMD)的遗传性肌肉变性疾病。他们还使用一种大鼠模型来模拟II型遗传性糖原贮积病。这些模型可能是测试创新疗法 (特别是基因疗法)的重要资源。
5.重磅!Nature和Science同日打擂台发表新型DNA/RNA碱基编辑器,可校正点突变
doi:10.1126/science.aaq0180; doi:10.1038/nature24644
自从5年前CRISPR热潮开始以来,科学家们就竞相开发这种强大工具的更加全面或的版本,从而能够极大地简化DNA编辑。本周发表在Science期刊和Nature期刊上的两项研究进一步扩大了CRISPR的使用范围,开发出一种更加微妙的被称作碱基编辑(base editing)的方法来修复遗传物质:一项研究扩展了一种编辑DNA的策略,而另一项研究通过对RNA进行碱基编辑而开辟了新的领域。
大量借用CRISPR工具包的碱基编辑系统很容易在非分裂细胞(nondividing cells)中实现碱基编辑。DNA具有4个核苷酸碱基:A、C、T和G,碱基编辑会将一个碱基改变为另一个碱基。在Liu的2016年那项研究中,他的团队将gRNA与一个“死的”Cas9(dCas9)融合在一起,dCas9不能够切割整个DNA双螺旋,但是仍然能够在正确的位点上让它解链。这些研究人员将酶APOBEC1附着到gRNA-dCas9上,这会触发一系列化学反应,终导致碱基C改变为碱基T。DNA的碱基配对规则控制着随后的碱基变化。这种配对规则规定一条DNA链上的T与另一条DNA链上的A配对。dCas9经进一步修饰后在未编辑的DNA链上产生切口,从而激活细胞的DNA修复机制,将初始与碱基C配对的碱基G转化为与这个新产生的T配对的A。
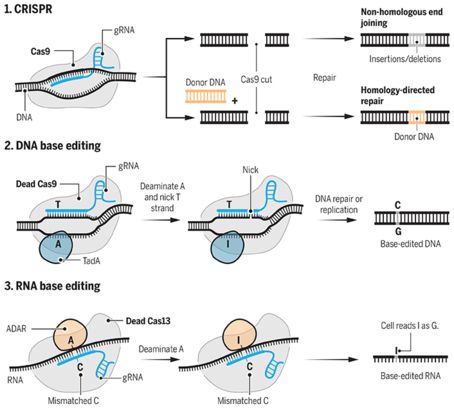
图片来自 C. BICKEL/SCIENCE; (DATA) D. B. T. COX ET AL., SCIENCE 358, 6362, 2017;J. DOUDNA AND E. CHARPENTIER, SCIENCE 346, 6213, 2014; GAUDELLI ET AL., NATURE 551, 7677, 2017。
这个DNA碱基编辑器并不能够解决与人类疾病相关的为常见的点突变(大约占一半):在应当为G•C的地方存在着A•T。如今,来自Liu团队的这个新的编辑器能够修复这种点突变。该团队再次将gRNA与dCas9融合在一起,但是已知没有一种能够将A转化为G的酶。因此,他们利用来自大肠杆菌的酶TadA开出一种新型酶。这种新型酶将A转化为一种被称作肌苷(inosine, I)的碱基。随后不论是一种细胞修复机制,还是DNA自我复制过程,都会将I变成G。美国哈佛大学CRISPR研究员George Church说,“在这项研究中,重要的事情是对TadA酶进行基因改造让它具备某种非天然的功能。”
张锋团队通过将gRNA与一种不同的没有切割活性的核酸酶dCas13和一种将RNA中的A转化为I的天然性酶融合在一起而构建出一种RNA碱基编辑器。与DNA中不同的是,这不会导致随后的碱基变化。含I的RNA仅像那个位点上存在一个G那样发挥作用。
6.Nat Biotechnol:在人全基因组水平上证实基于CRISPR的单碱基校正是准确的
doi:10.1038/nbt.3852
来自韩国基础科学研究所(Institute for Basic Science, IBS)基因组工程中心的研究人员证实了一种近期开发的基因编辑方法的准确性。这种基因编辑工具起着“DNA剪刀”的作用,旨在鉴定和替换人基因组(大小为30亿个碱基对)中的仅一个核苷酸(或者说碱基)。这是在全基因组水平上验证了这种“碱基编辑器(base editor)”的准确性。这种验证将有助扩大这种方法在农业、牲畜和基因疗法中的应用。相关研究结果于2017年4月10日在线发表在Nature Biotechnology期刊上,论文标题为“Genome-wide target specificities of CRISPR RNA-guided programmable deaminases”。论文通信作者为来自IBS基因组工程中心的Seuk-Min Ryu和Jin-Soo Kim。
为了鉴定这种方法的可靠性,Kim团队对一种被称作Digenome-seq的错误校验技术进行改进,以便让它适用于这种碱基编辑器方法。去年,当该团队分析了CRISPR-Cpf1和CRISPR-Cas9的准确性时,他们就使用和验证了Digenome-seq。他们也改进了计算机程序Digenome 2.0以便更加全面地鉴定脱靶位点,并且通过比较不同的gRNA发现降低脱靶编辑和增加特异性的gRNA。
7.Nat Biotechnol:利用CRISPR培育出单核苷酸编辑转基因小鼠
doi:10.1038/nbt.3816
人类DNA由大约30亿个核苷酸组成。在某些情形下,仅一个核苷酸发生变化就能够导致严重的疾病。科学家们希望利用一个正确的核苷酸替换这个不正确的核苷酸,从而治愈这些疾病。然而,利用当前的基因编辑工具CRISPR-Cas9替换单个核苷酸存在技术上的挑战。如今,在一项新的研究中,来自韩国基础科学研究所(Institute for Basic Science, IBS)基因组工程中心的研究人员利用这种流行的基因编辑技术CRISPR-Cas9的一种变体版本培育出单核苷酸编辑小鼠。相关研究结果于2017年2月27日在线发表在Nature Biotechnology期刊上,论文标题为“Highly efficient RNA-guided base editing in mouse embryos”。
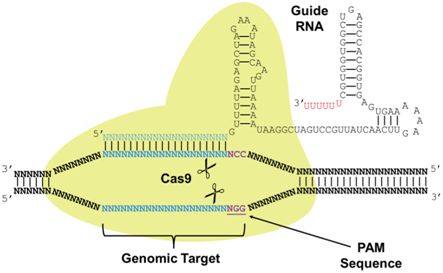
作为近年来出现的一种卓有成效的基因编辑技术,CRISPR-Cas9的作用机制是在DNA双链中的一个发生突变的核苷酸附近进行切割,切除一小段DNA序列。相反,IBS研究人员采用Cas9蛋白的一种变体:切口酶Cas9(nickase Cas9, nCas9),同时让Cas9与一种被称作胞苷脱氨酶(cytidine deaminase, CD)的蛋白融合在一起。CRISPR-nCas9-CD能够将一种核苷酸替换另一种核苷酸,因而也被称作碱基编辑器(Base Editor)。2016年,美国哈佛大学的David Liu团队和日本神户大学的Keiji Nishda团队已开发出这种类型的脱氨酶,并且在体外培养的细胞系中进行过测试。IBS研究人员通过将这种技术用于小鼠胚胎中,进一步推动它的发展。
IBS研究人员在小鼠体内测试了CRISPR-nCas9-CD是否能够校正Dmd基因(编码抗肌萎缩蛋白)或Tyr基因(编码酪氨酸酶)中的单个核苷酸。他们在这两种基因中都取得成功:由Dmd基因发生单核苷酸突变的胚胎发育而成的小鼠在它们的肌肉中不产生抗肌萎缩蛋白(dystrophin),而Tyr基因发生单核苷酸突变的小鼠表现出白化性状。抗肌萎缩蛋白确实与肌肉肌营养不良疾病相关联,而酪氨酸酶控制黑色素产生。
8.Science:利用改进的CRISPR/Cas9系统和特异性地实现单碱基突变
doi:10.1126/science.aaf8729
利用一种引入DNA单个核苷酸变化的脱氨酶,来自日本神户大学的研究人员构建出一种改进的CRISPR/Cas9工具,从而避免产生有害的双链断裂,使得利用CRISPR/Cas9技术引入的附带突变小化,而且也不需要加入DNA模板。相关研究结果于2016年8月4日在线发表在Science期刊上,论文标题为“Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems”。
为了构建一种更加准确的编辑工具,Kondo和他的同事们将一种没有核酸酶活性的不能够切割双链DNA的Cas9版本或一种产生单链切口的切口酶Cas9版本与一种来自七鳃鳗(sea lamprey)免疫系统的激活诱导性胞苷脱氨酶(activation-induced cytidine deaminase, AID)融合在一起。在正常情形下,这种AID酶在免疫球蛋白和抗体基因中产生突变从而让免疫系统具有多样性。AID作用在单链DNA上,将胞嘧啶(C)替换为尿嘧啶(U),随后在一轮DNA复制中,这种尿嘧啶(U)被转化为胸腺嘧啶(T)。
通过测试这种新的杂合复合物是否能够在出芽酵母---缺乏一种内源性的类似AID的系统---中修饰一种选择性的标志物,Kondo团队发现当在向导RNA(gRNA)的引导下,这种蛋白复合物靶向作用于CAN1基因,而且相对于非靶向的选择性标志物,CAN1基因发生突变的频率增加了1000倍。利用全基因组测序,研究人员发现很少的脱靶突变,只比背景突变率略有增加。论文作者、Kondo实验室博士后研究员Keiji Nishida说,“[在AID存在下],这种脱靶突变率是可以接受的,相比于自然的背景突变率增加了不到10倍。”(生物谷 )
