还怕细胞量不够吗?细胞传代操作无保留传授!
时间:2021-10-29 阅读:2503
细胞传代培养是细胞培养常规保种方法之一,也是几乎所有细胞生物学实验的基础。当细胞随着培养时间的延长和细胞不断分裂,细胞之间相互接触而发生接触性抑制,生长速度减慢甚至停止,且也会因营养物不足和代谢物积累而不利于细胞生长或发生中毒。因此,细胞在培养瓶中长满后就需要将其稀释,分种成多瓶,细胞才能继续生长。这一过程就叫传代。
细胞传代作为一种常规的实验操作,不但可以扩大细胞培养的数量,同时也可以避免细胞因进入平台期乃至衰亡期而大量死亡的窘境。所以为了让细胞保持在对数生长期,维持细胞旺盛的分裂能力,这时候就需要进行细胞传代。
细胞传代要在严格的无菌条件下进行,并且根据不同细胞采取不同的方法:
☑ 贴壁生长的细胞用消化法传代;
☑ 部分贴壁生长但贴壁不牢固的细胞可以采用直接吹打传代;
☑ 悬浮生长的细胞可以采用直接吹打或离心沉淀后再分离传代,或直接用自然沉淀法吸除上清后,再吹打传代。
上次讲了细胞复苏操作,今天来讲讲细胞传代的操作(适用于贴壁细胞的传代培养)!
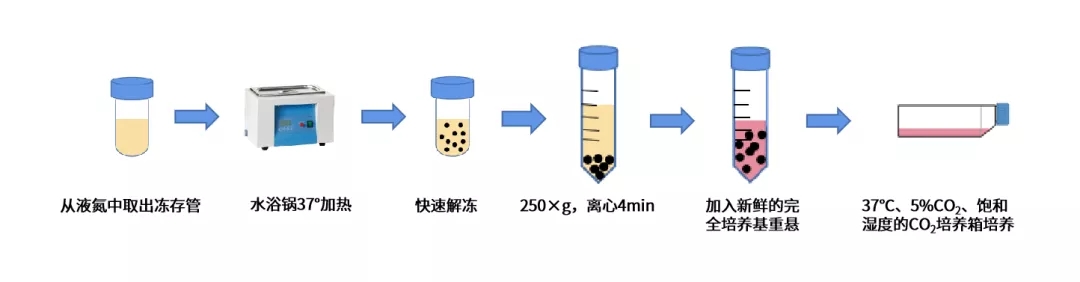
细胞复苏流程图
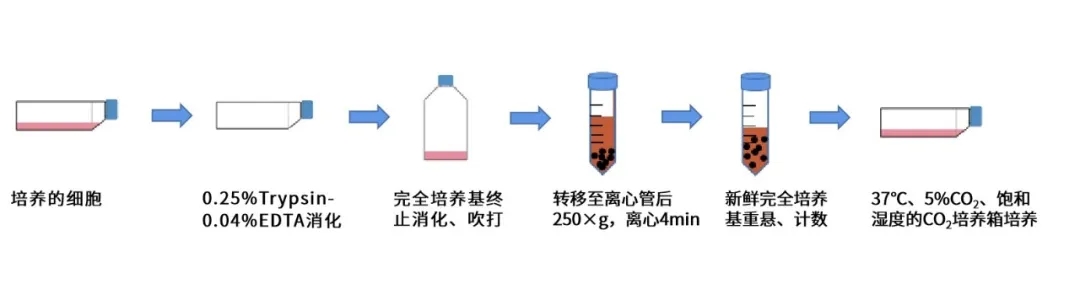
细胞传代流程图
01
细胞传代前准备
➡ 实验开始前,将15mL离心管、移液管、枪头等实验需要用到的耗材放入无菌超净工作台,紫外线照射30min。
➡ 将*培养基、PBS、胰酶预热至37℃。
➡ 倒置显微镜下观察细胞形态和生长密度,当细胞生长密度达到80%~90%汇合度即可进行传代。
02
胰蛋白酶/EDTA消化
➡ 弃去旧培养基,PBS洗去残留的旧培养基,重复洗两次。
注意:
贴壁加入到培养皿的边缘,不能直接对着细胞加入PBS,容易把细胞都吹起来。这一步的目的是为了去掉残余的培养基,残余的培养基会含有血清和一些离子等,不利于接下来的消化。
➡ 弃去PBS,加入0.25%Trypsin-0.04%EDTA(T25培养瓶加入约1.5mL,T75培养瓶加入约3mL),迅速铺匀,保证充分接触细胞表面(消化时间视具体细胞而定)。
➡ 显微镜下观察消化情况,约70%~80%细胞收缩变圆后,轻拍培养容器外壁,使细胞脱离培养表面。立即加入2倍胰酶量的*培养基轻摇培养容器,使培养基和胰酶迅速混匀,终止消化。
➡ 使用吸管或移液管轻轻吹打细胞表面,吹打培养容器底面数次,尽可能将细胞都吹打下来。
注意:
吹打动作不可剧烈,避免产生大量气泡,否则可能损伤和损失细胞。
➡ 取所有细胞悬液放入无菌15mL离心管内,250×g,室温离心4min。
03
细胞培养
➡ 离心后去除上清。加入适量*培养基,轻柔吹打细胞沉淀,充分吹散、混匀,计数。将细胞按(2.5~4)×104个活细胞/cm2接种至适宜的培养容器内。
➡ 摇匀细胞,放入37℃、5%CO2、饱和湿度的CO2培养箱中。
➡ 传代次日,观察细胞状态。若发现较多漂浮细胞,应予以换液。
➡ 待细胞生长至80%~90%汇合度,即需传代或冻存。
注意事项
胰酶浓度
推荐胰酶使用浓度为0.25%-0.04%EDTA,使用之前需预热至37℃且pH值应维持在7.2左右。切忌消化过度(包括胰酶浓度过高、消化时间过长等),否则会导致细胞死亡、分化、状态变差,分化能力丢失等现象。细胞消化过程中需要在显微镜下观察细胞的消化程度,当看到大部分细胞变圆不贴壁,拍打培养瓶两侧会有大量细胞脱落,此时应立即终止消化;若细胞仍有大部分贴壁,可适当延长消化时间以避免消化不*的情况出现。
细胞的差异
不同种类的干细胞差异很大,特别是与肿瘤细胞株的差异更大,很多经验不可以直接使用,消化时需要仔细摸索最佳的时间。
接种密度
干细胞传代过程中接种密度至关重要,如果太低会导致细胞增殖缓慢,甚至导致细胞老化,而细胞的老化是不可逆转的。一般细胞接种密度为20000个活细胞/cm2即5×105个活细胞/T25,不同的干细胞接种密度会稍有差异,比如hMSC,我们推荐的传代接种比例为1:2。
吹打细胞动作要轻柔
吹打动作不可剧烈,避免产生大量气泡,否则可能损伤和损失细胞。
