6小时完成8指标染色?!mIHC技术大盘点
时间:2024-06-13 阅读:940
2022年,“生物大分子与微生物组”被列为国自然重点项目,由此掀起了空间蛋白组学技术的研究热潮,其中免疫组织化学(IHC,Immunohistochemistry)作为最早的空间蛋白组学技术,衍生出了很多新兴的研究方法。IHC是利用抗原-抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色以确定细胞内抗原,并对其进行定位、定性及定量的研究。
随着空间蛋白组学技术的不断发展,利用IHC进行的传统多标记方案,也就是在连续切片上进行单标染色,很明显已经不能适用于研究人员的高通量检测需求。于是,mIHC技术就应运而生了,它可以做到在一个样本中进行多重荧光染色。相比于传统的组化技术,mIHC在复杂的肿瘤微环境中蛋白表达和共定位分析或其他生理过程中有较高应用价值,尤其是在样本数较少的情况下,可以做到同时检测多达10种荧光染料。
目前,mIHC有两大技术——经典的TSA技术和新兴的SignalStar技术。那么,这两种技术我们该怎么去选择呢?接下来就带大家一起来看看吧~
Part 01 TSA技术简介
1.TSA技术原理
酪氨酸信号放大 (Tyramide dignal amplification,TSA) 技术,是利用辣根过氧化酶 (Horseradish Peroxidase, HRP) 对靶蛋白进行高密度原位标记的酶学检测方法。简单来说,就是利用二抗上带有的HRP(而不是直接偶联荧光素),来催化后续添加入体系的非活性荧光素。荧光素在HRP和过氧化氢的作用下被活化,跟临近蛋白的酪氨酸残基共价偶联,使得蛋白样品与荧光素稳定结合;然后微波清洗,前一轮非共价结合的抗体被洗掉,共价结合的荧光素还留存在样品上。再换个一抗来第二轮孵育,周而复始。等到所有抗体孵育结束,荧光素都结合好后,最后去检测结果。
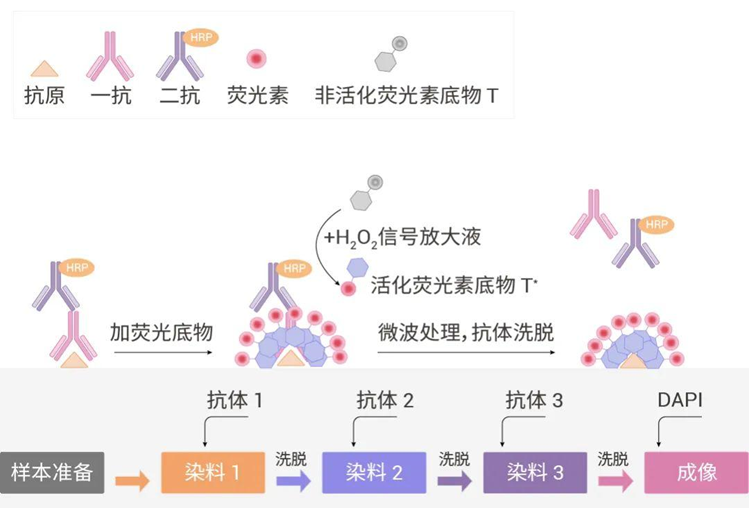
图1 TSA技术原理图
2. TSA操作步骤
1)使用TSA技术,你需要准备:严格验证的高特异性抗体、HRP偶联的针对一抗种属亚型特异的二抗、酪胺荧光素、多光谱成像系统;
2)孵育一抗二抗:利用二抗上带有的HRP催化后续添加入体系的非活性酪胺荧光素;
3)加入酪胺:酪胺荧光素在HRP和过氧化氢的作用下被活化,跟临近蛋白的酪氨酸残基共价偶联,使得蛋白样品与荧光素稳定结合;
4)微波清洗:通过微波清洗去除已连接的一抗和二抗,共价结合的荧光素还留存在样品上,再孵育新的靶点的一抗和二抗;
5)检测:等到所有抗体孵育结束,荧光素都结合好后,使用荧光显微镜检测结果。
相关产品推荐:
爱必信高性价比mIHC染色试剂盒推荐 | ||
货号 | 名称 | 用途 |
abs50012 | 四色多重荧光免疫组化染色试剂盒 | 荧光/共聚焦显微镜、扫描仪 |
abs50013 | 五色多重荧光免疫组化染色试剂盒 | |
abs50014 | 六色多重荧光免疫组化染色试剂盒 | |
abs50015 | 七色多重荧光免疫组化染色试剂盒 | |
mIHC辅助试剂 | ||
abs9179 | 4%多聚甲醛/通用型组织固定液 | 固定液 |
abs9247 | EDTA抗原修复液(50×) | 抗原修复缓冲液 |
abs9155 | 牛血清白蛋白(BSA) | 封闭液 |
abs929 | PAP Pen组化笔 | 组化笔 |
abs9234 | 抗荧光淬灭封片液 | 封片剂 |
Part 02 SignalStar™ Multiplex IHC技术简介
1. SignalStar技术原理
SignalStar技术是使用带有寡核苷酸标签的特异性抗体,结合du有的信号放大系统并使用荧光成像检测的多重免疫组化(mIHC) 技术,可在常规FFPE样本中同时检测3-8个靶标蛋白,且兼容常见下游成像平台及分析软件。
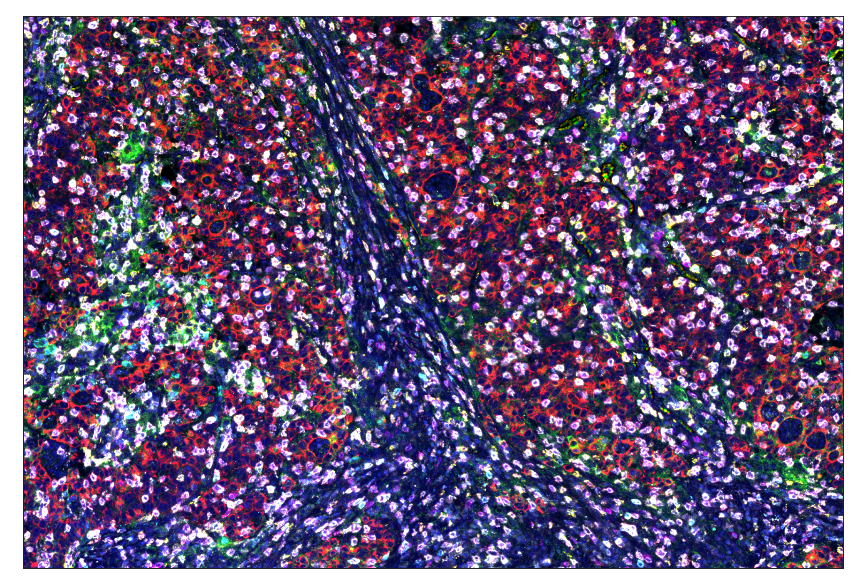
图2 对石蜡包埋的人胃腺癌进行 SignalStar™ 多重免疫组化分析结果图
2. SignalStar操作步骤
1)将寡核苷酸偶联的抗体加入到经过脱蜡,复水以及抗原修复处理的FFPE组织中;
2) 一次添加所有抗体,然后进行温和固定;
3)互补寡核苷酸与前4个抗体的偶联标签杂交;
4)使用荧光寡核苷酸产生并放大信号(AF488, AF594, AF647, AF750);
5)寡核苷酸连接;
6)寡核苷酸特异性酶去除所有荧光信号;
7)互补寡核苷酸与偶联抗体上的寡核苷酸标签进行第二轮杂交;
8)使用荧光寡核苷酸产生并放大信号(AF488, AF594, AF647, AF750);
9)寡核苷酸连接。
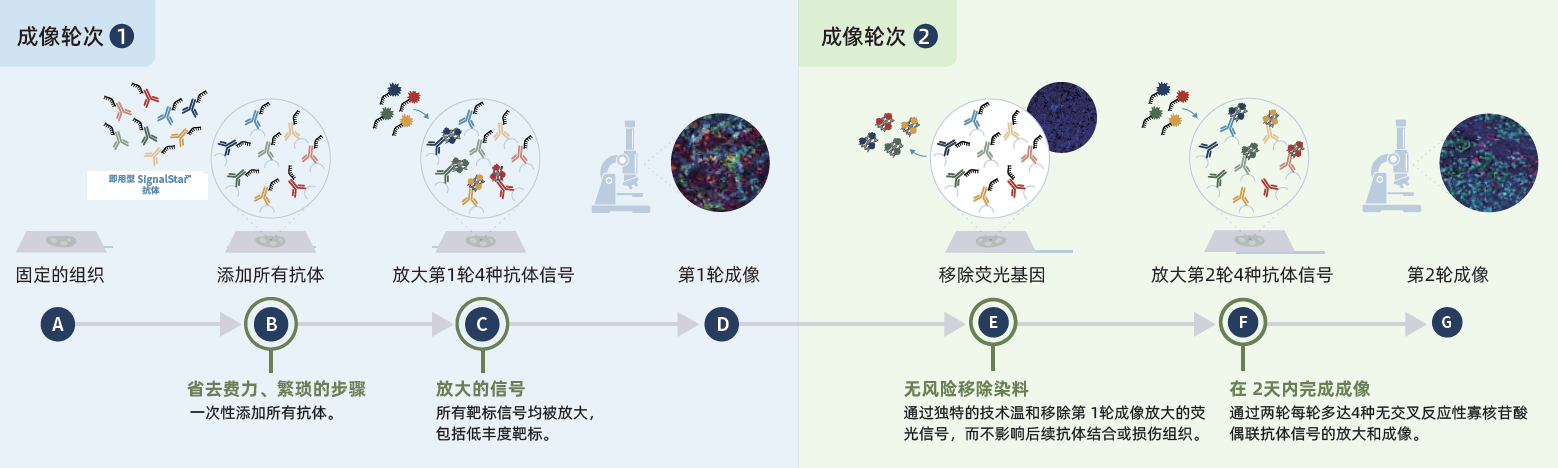
图3 SignalStar™实验流程图
Part 03 TSA 技术vs SignalStar技术
TSA技术与SignalStar技术各有优缺点,对比如下:
TSA | SignalStar |
同时标记多种蛋白(最多9标10色) | 同时标记多种蛋白(最多8标9色) |
一抗来源不再受限(同种属多标) | 一抗来源不再受限(同种属多标) |
连接辣根过氧化物酶的同种属二抗 | 荧光寡核苷酸不会导致表位遮蔽 |
强荧光防淬灭(无需避光操作) | 抗体一次性添加,节省时间 |
检测灵敏度超高,成倍提高荧光信号(增强10-1000倍) | 检测灵敏度超高 |
验证靶标多 | 组织结构、抗原不容易破坏 |
成本较低 | 优化过的实验方案,试剂齐全,傻瓜式操作,开箱即用 |
实验流程耗时长 | 验证靶标有限 |
对于研究者来说,进行mIHC实验需要准备抗体和多重荧光二抗试剂盒,可以提供4-7色的多色试剂盒及辅助试剂。除此之外,我们还可提供mIHC整体解决方案,包括试剂、服务等等。其中,爱必信多色服务最多九指标十色(含DAPI)的多重荧光免疫组化服务,样本种属涵盖人、小鼠、大鼠、猪等;组织类型以肿瘤样本居多,涵盖肺、胃、肝、肾、肠等各大器官,甲状腺、胰腺、唇腺、泪腺等各大腺体,另还有眼球、神经、大脑等特殊样本;切片类型涵盖石蜡切片、组织芯片(TMA)、冰冻切片、大组织切片、厚切片等,并提供全片扫描和定量分析。

图4 Absin全景多靶点染色成像分析平台
Part 04常见问题解答
Q1:波修复抗原每一轮染色都要做吗?可以用抗体洗脱液替代吗?抗体洗脱液用在哪个步骤?
A1:染第一个抗体之前做抗原修复,是为了使被石蜡或者固定剂封闭的抗原决定簇重新暴露出来,使得抗体能够识别到抗原;在染后面每一个抗体之前的抗原修复,目的是为了去除掉上一轮染色的抗体和残留没有结合上的染料,其实更准确的叫法是“抗体洗脱”,也就是说第一次的抗原修复是真正的抗原修复,后面的抗原修复实际上是“抗体洗脱”,“抗体洗脱”可以用抗体洗脱液(abs994)替换,特别是细胞、冰冻切片或者骨样本,但第一次抗原修复不能被抗体洗脱液替代,冰冻切片可以不进行抗原修复,染色效果欠佳时,可以考虑尝试进行抗原修复,推荐冰冻切片快速抗原修复液(5×)(abs9207)。
Q2:脱蜡水合步骤中“10%中性福尔马林浸片10min,灭菌水洗片1min,重复3次”目的是什么?我们以前做石蜡切片的时候没有这一步。
A2:这是后固定的步骤,固定充分的组织可以省略此步。
Q3:做好的多色片子,无法进行及时扫描,该如何保存?
A3:需要避光防震,在4℃条件下保存。
Q4:样本可以做成冰冻切片吗?
A4:可以的。抗原修复步骤不推荐用加热的方法,推荐用抗体洗脱液(abs994)
Q5:所有操作要避光吗?
A5:不需要,在常规环境下操作就可以,染料的荧光强度很高。
Q6:抗体修复液每一轮修复都要更换吗?
A6:是的,每一轮都要根据抗体选择相应的修复液。
Q7:染料的选择会影响后染色吗,有共定位的话怎么办?
A7:共定位的情况,我们可以通过单一通道观察来更好的检测各指标的分布情况,染料不会对染色有影响,串色的情况需要预实验做充足,包括抗体稀释比例,染料与放大液比例,修复条件的确定。
Q8:多色用的一二抗各是什么种属?
A8:多色的优势在于一二抗种属无需特别要求,一抗根据样本种属选择既可,二抗根据一抗选择即可,多个抗体组合,种属不会有影响。
Q9:抗体洗脱和微波修复哪种方式洗脱效果更好?
A9:微波修复洗脱更稳定,抗体洗脱液对大多数抗体都管用,难洗的抗体延长洗脱时间就可以啦!
Q10:我的组织还有GFP蛋白,给结果的时候能排除干扰吗?
A10:可以的,结果分析的时候可以避免绿色通道,分析软件赋予的颜色是伪彩色,可以更换其他颜色。
Q11:在指标与染料的搭配以及染色顺序上,有什么规律吗?
A11:并没有一个特别的线性关系,和蛋白的种类、表达量以及修复条件都有关系,所以会多因素考虑,多尝试,预实验很重要。
