使用蛋白标签特异性nanobodies进行基于珠子的蛋白分析
时间:2017-11-29 阅读:1579
Bead-based protein arrays using protein tag-specific nanobodies
使用蛋白标签特异性nanobodies进行基于珠子的蛋白分析
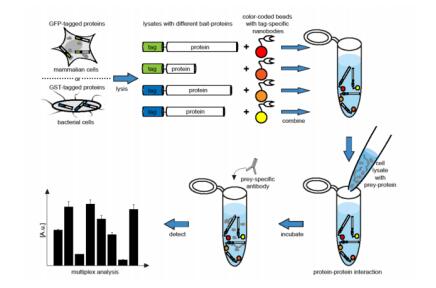
Figure 1 Workflow to generate bead-based protein arrays (BPAs) using tag-specific nanobodies and the application of such BPAs to study protein-protein interactions (PPIs). GFP- or GST-tagged bait-proteins are derived from small-scale expression cultures of bacterial or mammalian cells. Upon incubation of the crude lysates with color-coded beads (CCBs) comprising tag-specific nanobodies, bait-proteins are one-step purified and site-directed immobilized onto individual CCB populations, thereby generating BPAs. In the next step, cell lysates comprising the proteins’ interaction candidates to be analyzed (prey-proteins) are incubated with the BPAs. Finally, levels of prey-protein bound to the individual bait-proteins are quantified using tag- or gene-specific antibodies in a bead array reader.
背景
关于动态蛋白质-蛋白质相互作用(PPIs)的知识对于了解细胞过程和对这些相互作用的化合物的发现和验证是至关重要的。Bead-based protein assays(BPAs)是分析bait-蛋白质和prey-蛋白质之间的相互作用的新兴方法。然而,大多数研究仍采用细菌衍生的bait-蛋白质,由于它们缺乏转录后的修饰,或者在外源表达中不能正确折叠而有使用上的限制。
本应用笔记提出了一个新颖的方法来生成BPAs去结合与固定矩阵基质结合的微米级纯化的bait-蛋白质。在细菌或哺乳动物细胞内,bait-蛋白质与GST-或GFP-融合结构被生产出,并能使用ChromoTek高亲和力的特殊标签标记蛋白的nanobodies:GFP-Trap®或GST-Trap偶联的彩色珠子,一步纯化及固定溶菌产物。zui后,将这些bait-偶联的珠子结合在蛋白阵列中,用于小型多重GST -和GFP pulldown实验。zui近这项技术被成功地应用于研究蛋白酶体抑制或信号通路扰动后内源性prey-蛋白质β-catenin与一系列*的bait-蛋白质相互作用的动态变化(Groll N., et al., 2015) 。
结果
从细菌或细胞裂解物中,将GST-和GFP-标记的bait-蛋白固定在珠子上,生成一个基于bead的蛋白阵列(BPA)
运用原理论证研究测试概述的方法来分析蛋白酶体抑制或信号通路扰动后内源性β-catenin 与一系列*的bait-蛋白质的相互作用。为了生成基于珠子的蛋白阵列(BPAs),建立了一个两步法生成*的bait-蛋白质的方法。首先GST-或GFP-特异性nanobodies共价偶联上彩色编码珠子(CCBs)。随后,这些CCBs与油溶性的细菌或细胞裂解产物孵育,包括β-catenin特异性bait-蛋白质ICAT, ECT 和TCF4或者是GST-或GFP-融合结构,相应的bait-蛋白质固定在nanobody包被的CCBs上。CCBs的检测饱和度为50 µg/ml的总蛋白浓度。因此,BPA生产的标准条件是100 µl 1 mg/ml的油溶性蛋白提取物与大约200000珠子偶联。显然,检测表明不同的CCB集群不发生蛋白转移,这说明了在一段时间内,不同的珠子集群上的bait-蛋白质是没有交换的。
蛋白质-蛋白质相互作用分析
为了确定和比较固定后bait-蛋白质的功能,我们应用BPAs目标多远分析来检测复合实验中绑定的β-catenin的动态变化。β-catenin是标准Wnt通路的关键效应分子。β-catenin在细胞中的浓度受细胞质破坏复合体严格控制(Liu C, et al., 2002)。由于Wnt受体的外在活性,破坏复合体功能被灭活(Huang H, et al., 2008),导致细胞质内hypo-磷酸化β-catenin的积累,以及转位进入细胞核中,在细胞核中它与淋巴增强因子/T细胞因子(LEF/TCF)家族相互作用,从而激活Wnt应答基因的转录(Moismann C., et al., 2009) 。除了作为转录因子,β-catenin还作为细胞膜与细胞骨架间的受体分子,与细胞黏附蛋白家族钙粘蛋白,α-catenin和肌动蛋白形成蛋白复合体。
在我们的研究中,我们通过针对β-catenin的稳定性调节了标准Wnt通路的活性。因此,我们使用MG132抑制了β-catenin蛋白酶体降解。另外我们使用了GSK3β的特异性抗体CHIR-99021 (CHIR)来阻断β-catenin的磷酸化及泛素化,从而模拟Wnt通路的状态(Bennett CN, et al., 2002)。如前所述,我们使用BPAs来监测内源性β-catenin结合性的动态变化,从而选择复合实验的bait-蛋白质。因此,用分离自处理或未处理过的HEK293T的 20µg 蛋白提取物与BPAs一起孵育。用MG132和CHIR同时处理,会导致强烈的可测量的内源性β- catenin与三种bait-蛋白质:ICAT, ECT和TCF4的相互作用(Fig.2)。然而,这两种抑制剂的影响很小,有限数量的β-catenin能被这三种bait-蛋白质捕获而显示显著差异(Fig.2)。
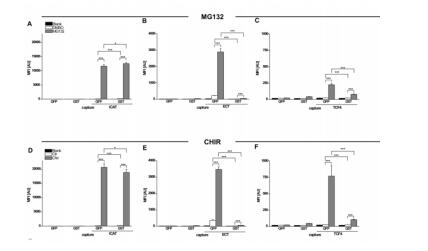
Figure 2 Multiplex analysis of β-catenin binding profiles to different bait-proteins upon GSK3β or proteasome inhibition. BPAs comprising the GFP- or GST labeled bait-proteins ICAT (A & D), ECT (B & E) and TCF4 (C & F) were incubated with soluble protein fractions derived from HEK293T cells. To modulate the levels of endogenous β-catenin, HEK293T cells were either left untreated (blank), or incubated with 10 µM MG132 (proteasome inhibitor), or DMSO as a control (A, B and C) or treated with 10 µM CHIR (GSK3β-inhibitor) and H2O as a control (D, E, and F). Bound levels of β-catenin were detected using a monoclonal anti-β-catenin antibody. Shown are mean fluorescence intensities (MFI) and standard deviations of three independent biological experiments. Statistical significance was evaluated with the students t-test (*p≤0.05; **p≤0.01;***p≤0.001).
ICAT作为bait-蛋白时,细胞β-catenin水平的明显增加,而ECT和TCF4作为bait-蛋白时程度较小。值得注意的是,分离自两个不同的表达系统的标记蛋白的使用,造成了内源性β-catenin结合水平的显著差异。由于bait-蛋白ECT和TCF4存在,GFP-versions比GST-tagged能够结合更多的β-catenin。我们的研究结果表明,与相应的GST-fusions相比,GFP-ECT处理后β-catenin信号高出50倍,GFP-TCF4处理后β-catenin信号高出4倍。这表明,当这些bait-蛋白表达并与哺乳动物溶菌产物结合后,它们的功能会提升。
结论
高亲和性特异性标记的nanobodies的应用,能直接从真核生物和原核蛋白表达培养物中产生一种、快速、可再生的基于珠子的蛋白阵列(BPAs)。我们通过分析信号蛋白β-catenin与三种相互作用物的结合表现,展示了真核表达系统的优势。我们认为这种方法适用于研究细胞通路中蛋白质上的小分子的作用,并通过BPAs为媒介扩展到高通量模式。新的高亲和性标记nanobodies对于额外蛋白质或标签肽的特异性识别,将大大增加这种方法的使用机会。
原文献链接:点此进入
