行业资讯——解读近年胚胎干细胞研究领域成果!
时间:2022-10-26 阅读:874
01
Science:重磅!分子伴侣介导的自噬调节胚胎干细胞的多能性,有望开发新的再生疗法
doi:10.1126/science.abb4467
图片来自CC0 Public Domain
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现胚胎干细胞中称为CMA(chaperone-mediated autophagy, 分子伴侣介导的自噬)的自噬过程可能作为修复或再生受损细胞和器官的新型治疗靶点。相关研究结果发表在Science期刊上。
人体包含200多种不同类型的特化细胞。所有这些细胞都可以由胚胎干细胞(ESC)分化而来。胚胎干细胞不断地自我更新,同时保留了分化为成年动物中任何一种细胞类型的能力,这种状态称为多能性。科学家们已知道细胞代谢在这一过程中起到了一定的作用;但是,目前还不清楚细胞的内部线路究究竟如何起作用以保持这种状态并最终决定干细胞的命运。这项新的临床前研究shou次展示了胚胎干细胞如何将CMA保持在低水平,以促进这种自我更新,而且我们揭示了两种可能操纵胚胎干细胞自我更新和分化的新方法来关闭这种抑制,以增强CMA活性和让它们分化成特化细胞。
02
Nature:重磅!科学家利用人类胚胎干细胞成功开发出人类胚胎样模型!
doi:10.1038/s41586-020-2383-9
图片来源:Naomi Moris
近日,一项刊登在国际杂志Nature上的研究报告中,来自剑桥大学等机构的科学家们通过研究利用胚胎干细胞开发出了一种新型模型来研究人类的早期发育阶段。这种模型类似于18-21天大小的胚胎的一些关键元素,其能帮助研究人员观察到人类机体形成的潜在过程,这是以前从未直接观察到的,而理解这些过程则能够帮助研究人员揭示人类出生的缺陷和疾病发生的原因,同时就能在孕妇群体中开展相关的检测。
这种计划或机体蓝图是通过一种名为“原肠胚形成"的过程开始的,在原肠胚形成过程中,胚胎会形成三层不同的细胞,这些细胞随后会转化成为机体的主要系统,即外胚层会形成神经系统,中胚层能形成肌肉,而内胚层则能够形成肠道。原肠胚阶段通常被称为人类发育的“黑箱期"(black box),因为法律限制禁止在第14天之后在实验室培养人类胚胎,而这一过程是从第14天开始的,这个限制设定在胚胎不能形成双胞胎的阶段。
03
Cell Rep:研究揭示RNA分子对于胚胎干细胞分化的重要性
doi:10.1016/j.celrep.2019.10.011
胚胎干细胞(ESC)具有自我更新的双重能力和分化的潜能,而两者都需要受到严格的调节控制。在ESC分化过程中,干细胞会发展为特殊的细胞类型,例如皮肤细胞,神经细胞,肌肉细胞等。虽然我们对ES细胞调控的理解主要在于转录和表观遗传差异等方面,但我们对转录后调控的作用仍知之甚少。
最近,丹麦的一个研究小组发现了由PolyA-tail eXosome Targeting'(PAXT)调控的核RNA水平升高以及Polycomb Repressive Complex 2(PRC2)调控的转录之间的关系。研究人员提出,过量的RNA会通过隔离DNA来阻碍PRC2的功能。他们的结果强调了核RNA水平稳态的重要性,并证明了大分子RNA调节染色质相关蛋白的能力。
04
MSB:转录因子浓度的时间波动或会影响胚胎干细胞的分化命运
doi:10.15252/msb.20199002
图片来源:D.Suter, EPFL
蛋白质浓度的时间变化如何影响生物学?这是一个生物学家们最近才开始研究解决的问题,而且越来越多的研究结果表明,特定蛋白质数量的随机时间变化在生物学过程中起着直接而且重要的角色。近日,一项刊登在国际杂志Molecular Systems Biology上的研究报告中,来自瑞士洛桑联邦理工学院等机构的科学家们通过研究发现,蛋白质浓度的时间波动或能决定胚胎干细胞所转变的细胞类型。
文章中,研究者对两种名为SOX2和OCT4的重要转录因子进行研究,这两种转录因子的水平在胚胎干细胞中会随着时间的改变而发生改变,其对于胚胎干细胞的自我更新及分化为特定细胞类型都非常重要。为了监测转录因子的时间波动,研究人员进行了非常复杂的基因工程操作,在一条胚胎干细胞线上制造了5个敲入的“报告"基因(reporter genes),这些是附在相关基因附近的基因,当细胞中靶向基因被表达时,其就会产生可见信号,比如荧光,随后当其产生相应蛋白时其就会“报告"。
05
Nat Biotechnol:人类胚胎干细胞来源的心外膜细胞增强心肌细胞驱动的心脏再生
doi:10.1038/s41587-019-0197-9
图片来源:Nature Biotechnology
心外膜及其衍生物为发育和成体心脏提供营养和结构支持。为此,来自华盛顿大学的Charles E. Murry和剑桥大学的Sanjay Sinha合作测试了人类胚胎干细胞(hESC)来源的心外膜在体外增强工程心脏组织的结构和功能的能力,并提高hESC-心肌细胞移植在心肌梗死大鼠心脏中的疗效。相关研究成果发表在Nature Biotechnology杂志上。
与间充质间质细胞相比,心外膜细胞显着增强了人工程心脏组织的收缩力、肌原纤维结构和钙处理能力,减少了被动刚度。移植的心外膜细胞在梗死的心脏中形成持久的成纤维细胞移植物。hESC来源的心外膜细胞和心肌细胞在体内的联合移植使移植物心肌细胞的增殖速度增加了一倍,使心脏移植物的尺寸增加了2.6倍,同时增强了移植物和宿主的血管化。值得注意的是,与单独接受心肌细胞、心外膜细胞或载体的心脏相比,联合移植改善了心脏的收缩功能。
06
Nat Cell Biol:利用人胚胎干细胞构建出的胚状体揭示BMP4破坏胚胎对称性
doi:10.1038/s41556-019-0349-7
图片来源:Mijo Simunovic et al.doi:10.1038/s41556-019-0349-7
人类胚胎如何打破对称性是一个谜。在一项新的研究中,来自美国洛克菲勒大学的研究人员利用人胚胎干细胞(ESC)在实验室中构建出早期人类胚胎模型,并且这种模型要比之前任何实验室构建的胚胎模型都要复杂。他们还发现蛋白BMP4的使用破坏这些胚胎模型(称为胚状体)的对称性,或者说从圆球体变为一种具有前端和后端的结构。令人吃惊的是,这能够发生在含有BMP4但没有母体因子或胚胎外组织的胚状体(embryoid)中,相关研究结果发表在Nature Cell Biology期刊上。
研究者表示,这种对称性破坏过程是发育生物学的一个重要圣杯。我真地觉得我在研究我们自己存在的最神秘的方面之一。这些研究人员将分离的人胚胎干细胞置于含有水凝胶和胞外基质样支架的培养皿中,发现它们将自我组装成与10天大的人类胚胎(即所谓的上胚层阶段)相当的球体,即胚状体。当他们添加BMP4时,这些胚状体出现了前后极性,包括类似原始条纹的迹象,从而在胚胎中建立了中线。
07
Nat Commun:如何维持胚胎干细胞的无限潜能?
doi:10.1038/s41467-018-07528-9
图片来源:Salk Institute
胚胎干细胞(ESCs)具有*的潜能,其能够转化成为机体任何一种类型的细胞,一旦其开始沿着某一特定的路径转化成为某种特定的组织,胚胎干细胞就会失去无限的潜能,如今科学家们尝试理解这一过程发生的方式和原因,旨在开发新型再生疗法,即诱导机体自身的细胞替代受损或疾病的器官。近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自索尔克研究所的科学家们通过研究开发了一种新型蛋白复合体,其能抑制干细胞的发展,从而使其能够维持无限的潜能;这种名为GBAF的复合体或有望作为后期科学家们开发新型再生医学疗法的潜在靶点。
研究者Diana Hargreaves教授表示,这项研究中,我们始于对胚胎干细胞多能性的探索,这种多能性能够促进胚胎干细胞转化成为机体中任何一种类型的细胞,阐明控制干细胞多潜能性的多种基因网络非常重要,因此能够找到一种在这一调节过程中扮演关键角色的未知蛋白,对于研究者而言也是非常有意义的。机体中的每一个细胞都有着相同的一套DNA元件,其包含有制造每一种可能性细胞类型的指令;大型的蛋白复合体(染色质重塑器)能够激活或沉默基因的表达,指导胚胎干细胞进入到一种特殊的路径中,就好比一群计划装修房子的承包商们,这些蛋复合体也包含有多重亚单位,不同亚单位的组合就能够改变DNA的物理形状,并且决定哪些基因能够指挥干细胞分化成为肺部细胞或大脑细胞。
08
Nature:胚胎干细胞在体外自我组装成胚胎样结构
doi:10.1038/s41586-018-0578-0
图片来自Nature, doi:10.1038/s41586-018-0578-0
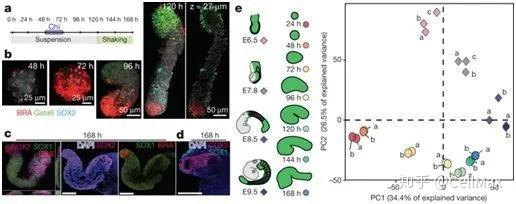
哺乳动物身体的结构在胚胎植入子宫后不久就已建立。身体的前后轴、背腹轴和中间外侧轴在协调胚胎的各个区域中的DNA转录的基因网络的调节下便已确定了。如今,在一项新的研究中,来自瑞士日内瓦大学、洛桑联邦理工学院和英国剑桥大学的研究人员报道了小鼠胚胎干细胞产生表现出类似能力的伪胚胎(pseudo-embryo, 即胚胎样结构)。相关研究结果在线发表在Nature期刊上。
这些被称作类原肠胚(gastruloid)的结构仅由大约300个胚胎干细胞组成,表现出具有与6至10天龄胚胎后部相似的发育特征。这项研究表明,三个主要的胚胎轴是根据类似于胚胎的基因表达程序形成的。因此,类原肠胚有重大的潜力用于研究哺乳动物正常或病理性胚胎发育的早期阶段。因难以获得早期哺乳动物胚胎,对协调它们形成的过程进行研究是很难开展的。英国剑桥大学遗传学系教授Alfonso Martinez Arias及其团队近期发现,在某些条件下,小鼠胚胎干细胞能够组装成三维聚集体,这种三维聚集体在体外培养时持续伸长。这些被称为“类原肠胚"的实体显示出胚胎发育早期阶段的不同特征。
09
Nature:利用胚胎干细胞从头构建定制的大脑区域
doi:10.1038/s41586-018-0586-0
图片来自Nature, doi:10.1038/s41586-018-0586-0
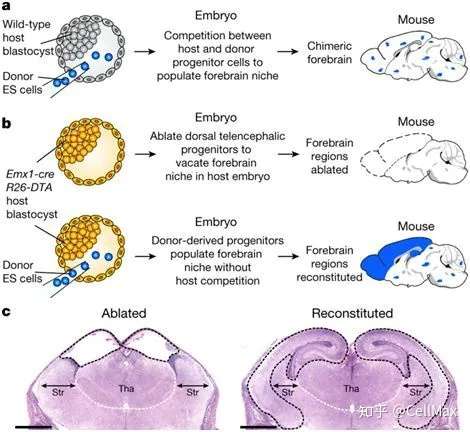
在一项新的研究中,来自美国波士顿儿童医院和加州大学旧金山分校的研究人员描述了一种新方法来构建定制的小鼠模型来研究大脑。首先,一种天然的毒素可用于在小鼠胚胎中杀死通常生长在前脑中的年轻脑细胞。随后就可利用经过基因改造的含有研究所需的特定遗传修饰的胚胎干细胞重建小鼠正在发育中的前脑。相关研究结果在线发表在Nature期刊上。
这种“前脑替换(forebrain substitution)"导致遗传学特征受到严格控制的功能齐全的小鼠幼仔,从而允许科学家们能够在更大程度的控制下研究特定基因如何影响大脑疾病。研究者Fred Alt博士说,“我们认为这种策略是神经生物学家研究大脑许多方面的一种全新平台,从哪些基因控制大脑发育的基本知识到可能为脑癌和精神疾病寻找新的基因疗法。"
10
Nature:重磅!构建出潜能性比胚胎干细胞和诱导性多能干细胞更强的干细胞系
doi:10.1038/nature24052
图片来自CC0 Public Domain
在一项新的研究中,来自中国、美国、英国、日本和澳大利亚的研究人员shou次在小鼠中构建出潜能扩展性干细胞(Expanded Potential Stem Cells, EPSC),它们比当前的干细胞系具有更大的发育潜力。这些干细胞具有发育中的胚胎内的最初细胞的特征,而且能够发育成任何一种细胞类型。相关研究结果在线发表在Nature期刊上;干细胞能够分化为其他的细胞类型,而且现存的干细胞系对发育、疾病和治疗研究已经非常有用。然而,两种当前可用的干细胞系---胚胎干细胞(ESC)和诱导性多能干细胞(ipsC)---具有某些限制。目前,它们还不可能分化为每种细胞类型,因此在产生某些细胞类型时,它们被排除在外。
为了发现用于研究和再生医学的新型干细胞,这些研究人员开发出一种培养处于发育最早阶段---在此时,受精卵仅分裂为4或8个细胞,仍然被认为具有一些全能性(即分化为所有细胞类型的能力)---的细胞的方法。他们猜测相比于从大约100个细胞阶段(即胚泡期)获得的ESC相比,这些细胞应当接受更少的编程。他们在一种特殊的抑制关键的发育信号和通路的培养条件下培养这些早期的细胞。
