探索应用示例
> 单个心肌细胞收缩力测定:量化单个心肌细胞的搏动力
> 牵引力测定:细胞施加在基质上的力的量化
其他品牌 品牌
代理商厂商性质
北京市所在地
细胞内源力分析装置
高通量细胞收缩测试装置
1、心肌细胞成熟度测定
功能性 iPSC 诱导的心肌细胞纤维
2、牵引力测定
细胞在基质上施加的力的量化
3、Durotaxis 和 haptotaxis 测定
控制基材刚度
4、3D CM 成熟度测定
评估 iPSC-CM 的跳动
5、单CM收缩力
单个心肌细胞搏动力的量化
一、细胞收缩力高通量检测多孔板-24、96、384孔板:

图1:原理图:
1.1)细胞收缩力测试24孔板

1.2)细胞收缩力测试96孔板
1.3)细胞收缩力测试384孔板

细胞内源力分析装置 凝胶微柱制备
图案的*微孔板,上面有100,000多个均匀分布的X或+形的具有粘性蛋白质微图案,细胞沉降并附着在其上,嵌入板中的X具有弹性,因此每当细胞收缩时它们就会收缩。 X带有分子标记,可以发出荧光,从而可以成像和量化缩小的形状。
可以成像和定量,因此研究人员可以将X或十字架的变形与单个细胞或成千上万个细胞的一定量的力相关联。该技术还为研究人员提供了查看单个细胞钙反应以及它们与细胞强度之间的关系的能力。
该技术也可以用于药物发现。研究人员可以快速,轻松地测试不同的治疗分子,以了解它们如何影响细胞力以及是否可以纠正任何潜在的力问题。
在具有可控刚度的弹性薄膜中嵌入用户设计的粘合剂和荧光微图案,形成非常密集但均匀的阵列(> 120微米/每平方毫米)。100000个患者来源的单细胞(地从疾病起源的人体组织中获得)独立地定位并粘附在微图案上(每个微图案一个细胞),它们对该微图案施加牵引力并明显改变其形状,从而能够在*的吞吐量下对细胞收缩性进行直观的基于图像的评估。
1)荧光弹性可收缩表面的微图案化
—在具有可控刚度的弹性薄膜中嵌入用户设计的粘合剂和荧光微图案,形成非常密集但均匀的阵列(> 120微米/每平方毫米)。100000个患者来源的单细胞(地从疾病起源的人体组织中获得)独立地定位并粘附在微图案上(每个微图案一个细胞),它们对该微图案施加牵引力并明显改变其形状,从而能够在*的吞吐量下对细胞收缩性进行直观的基于图像的评估。

2)基于图像的受控单细胞收缩性的动力学可视化
—例如,384孔板内的每个附着细胞的微图案在延长的时间内以精细的时间分辨率被独立监控,以直接观察收缩行为的全部范围,从紧张性收缩到诱导性收缩或松弛,以及任一效应的作用窗口。选择“x”形微图案以小化细胞-基底接触面积,同时大化细胞扩散面积,从而在不同位置产生放大和集中的力。由于每个微图案都与其他微图案机械分离,粘附的细胞不会将应变传递给相邻的微图案,从而确保对群体中每个单个细胞的收缩力进行可靠的评估。
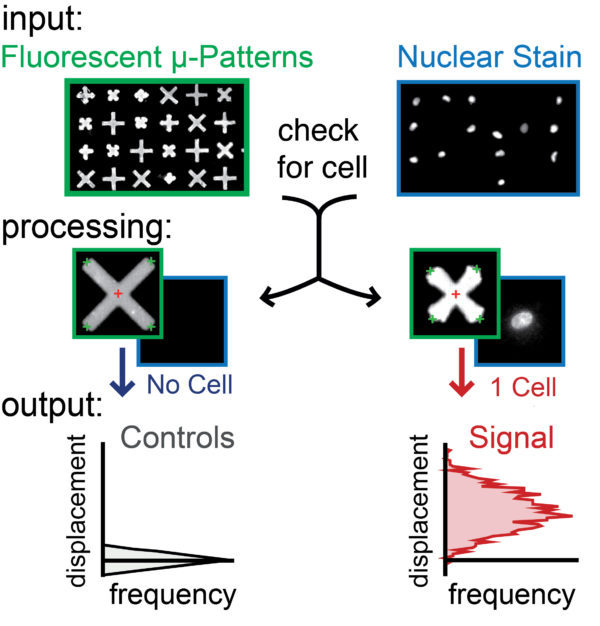
3)单细胞收缩性的自动化和直观的图像分析
—基于该方法的检测产生直观、明确的收缩信号——提供直接的图像分析,以从成像群体中的每个单细胞获得定量和可靠的数据。
可以同时获取1000多个均匀图案的单细胞的强大的收缩性数据,并与96-和384孔板格式无缝地集成,以促进大规模的药物筛选
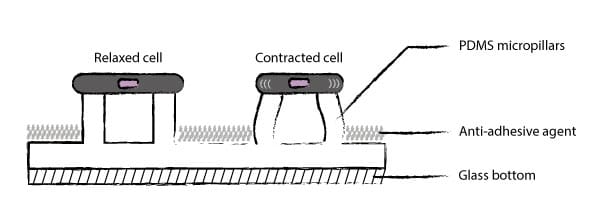
二、细胞牵引力显微镜及微柱阵列介绍

图4:细胞牵引力显微镜

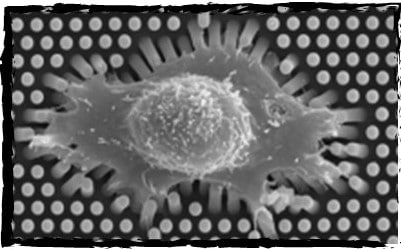
图5:细胞微柱阵列,可定制刚度、大小、形状和间距。
●PDMS微柱的偏转可实现力感测
●PDMS微柱的刚度由其尺寸(Durotaxis)控制
●提供几种微柱几何形状和布置
●单细胞力作图(牵引力显微镜)
●可控的生物功能化
●适应任何细胞培养底物(从培养皿到96孔板)
●与高分辨率光学显微镜系统兼容
典型应用:
>单心肌细胞收缩力测定:定量单心肌细胞的搏动力
>牵引力测定:定量细胞在基质上施加的力
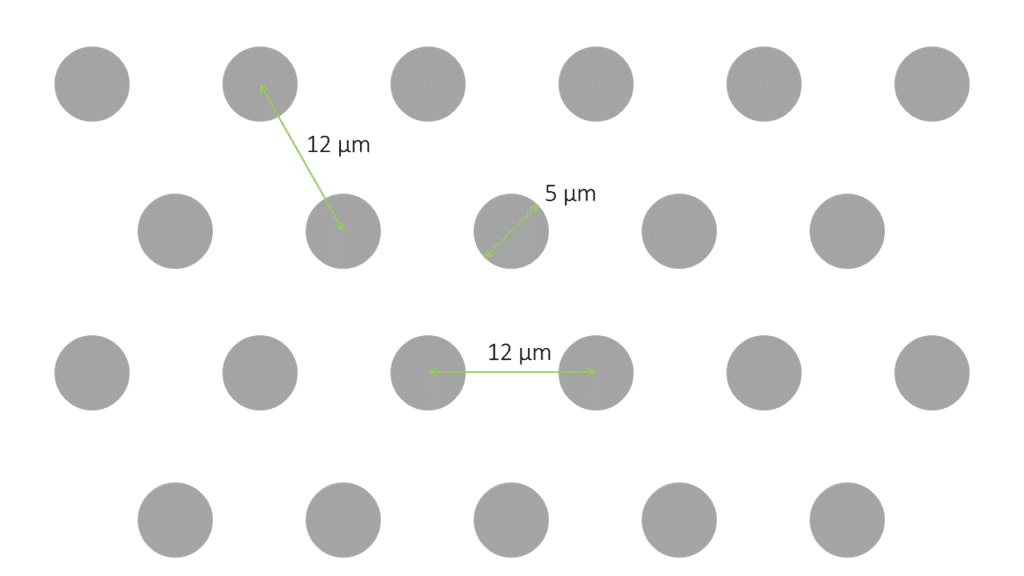
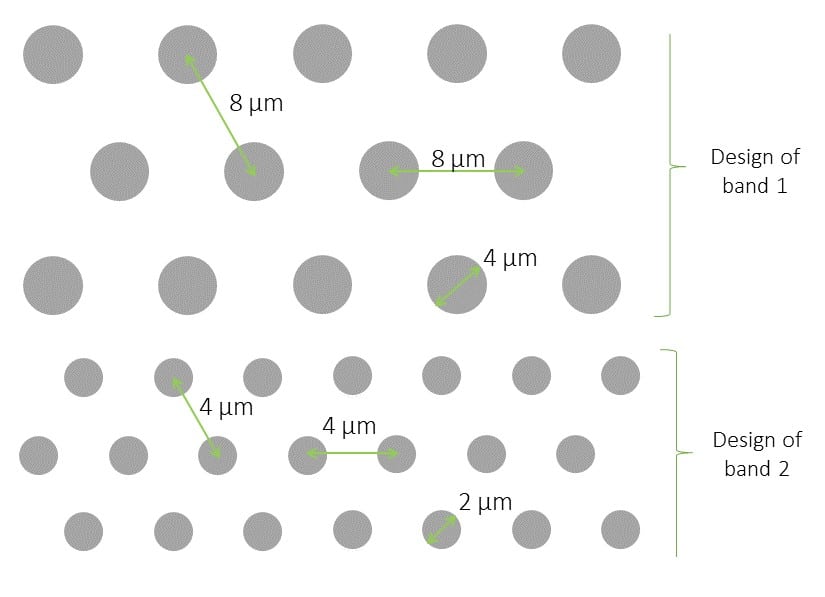
1、圆形PDMS微柱10 mm盖玻片:
标准尺寸:24 mm圆形盖玻片(约170μm厚度)
设计:直径为5 ?m; 中心到中心的距离为7 ?m
三种高度可供选择:2 ?m,6 ?m和12 ?m
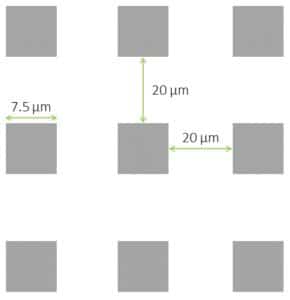
3、方形微柱盖玻片
设计:直径7.5 ?m; 微柱之间的距离为20 ?m
三种高度可供选择:2 ?m,6 ?m和12 ?m
在该测定中,衍生的心肌细胞附着于矩形细胞粘附区域,从而诱导细胞伸长并促进两个相邻微柱之间的悬浮细胞锚定。收缩力测定能够在体外复制导致 CM 跳动的兴奋-收缩耦合效应。
探索应用示例
> 单个心肌细胞收缩力测定:量化单个心肌细胞的搏动力
> 牵引力测定:细胞施加在基质上的力的量化
4. 可定制的直径、高度、间距
我们提供带有微型PDMS微柱的10毫米盖玻片,用于细胞培养和力评估。
不同的支柱设计和布置适合各种应用,例如牵引力显微镜,收缩力和旋转轴。
通过测量PDMS微柱响应于细胞施加的力的挠度来进行力评估。
>多种设计可供选择
可用高密度和低密度微柱以及不同纵横比的基板。
>兼容高分辨率显微镜。
易于观察细胞及其对微柱变形的影响
> 简介
为了充分了解活细胞的复杂形态和功能,必须考虑细胞的高度动态特性,例如其 3D 结构、机械性能和生化环境 。 长期以来,体外 细胞培养技术一直是重要的研究和工业工具 ,用于通过从癌症药物筛选到发育生物学 [3] 等众多研究来更好地了解细胞行为。细胞培养传统上是基于二维玻璃、聚苯乙烯或硬塑料基板。这些基于“培养皿”的细胞培养物产生的细胞单层由于无法 在体内重建细胞而受到严重限制 细胞微环境,因此不代表在生物体中发现的那些[。因此,在 2D 细胞培养研究中测量的生物学反应(例如受体表达、细胞迁移和凋亡)可能与发现细胞的原始组织或环境的生物学反应显着不同 。