大鼠下丘脑神经干细胞(NSCs)分离培养
时间:2023-08-07 阅读:194
基本信息
细胞名称:大鼠下丘脑神经干细胞 (NSCs)
组织来源:下丘脑
细胞形态:集落,克隆球状
生长特性:悬浮培养
支原体:无
背景简介:神经干细胞的起源:Reynolds等于1992年从小鼠纹状体分离出能在体外不断分裂增殖并具有多向分化能力的细胞群,第一次提出了神经干细胞(NSCs)的概念。
1997年,NSCs被定义为一类能够自我更新并具有分化为神经元、星形胶质细胞和少突胶质细胞能力的细胞。中枢神经系统是NSCs的主要分布场所,能够作为NSCs的直接来源,而近几年发展起来的转分化技术使神经干细胞的来源迅速扩展,获取途径更为广泛。
细胞形态
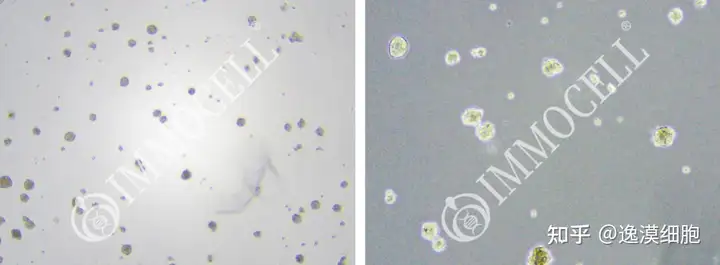
大鼠下丘脑神经干细胞原代培养
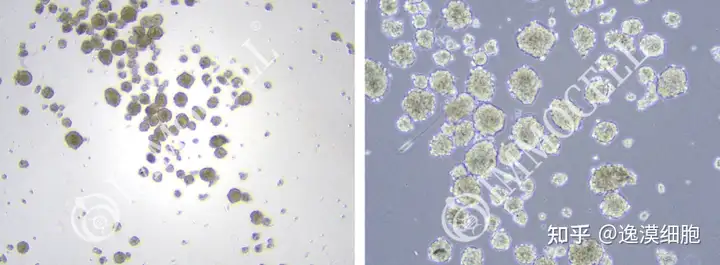
大鼠下丘脑神经干细胞传代培养
细胞特点
1. 具有自我维持和更新能力
2. 具有多向分化潜能:
在不同因子下,可分化出不同类型的神经细胞,损伤或者疾病可以刺激神经干细胞分化。
3. 免疫源:
NSCs是未分化的原始细胞,不表达成熟的细胞抗原,不被免疫系统识别。
4. 组织融合性:
可以与宿主的神经组织良好融合,并在宿主体内长期存活。
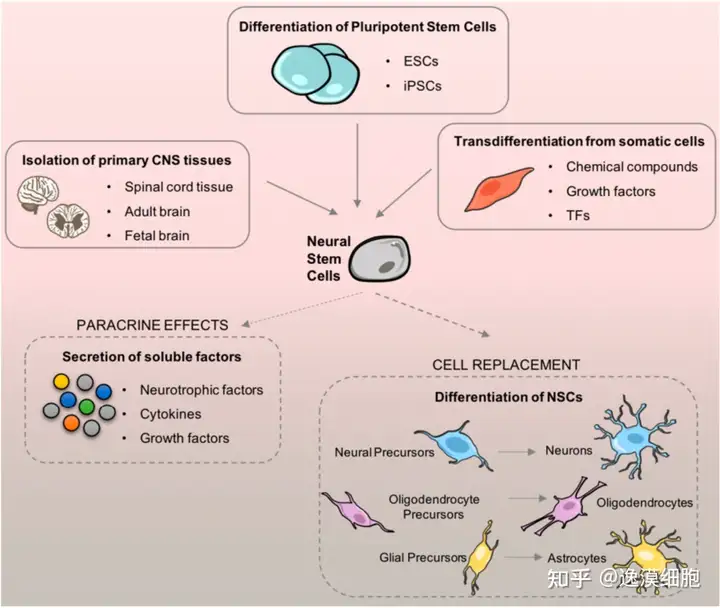
NSCs来源
胚胎源NSCs、成体脑源性NSCs、成体脊髓源性NSCs、骨髓源性NSCs、脐血源性NSCs、脂肪源性NSCs。
材料准备
仪器:倒置显微镜,离心机,安全柜,显微剪,尖头镊,微型剪,50mL离心管,10cm培养皿,细胞计数仪,40μM细胞筛,15mL离心管
试剂:NSCs神经干细胞专用培养基、NSCs神经干细胞专用消化液、PBS磷酸缓冲液。
操作步骤

提前开启紫外线照射超镜台30分钟,超镜台通风10分钟以上,水浴锅提前开启加热至56℃,提前准备好移液管、T75培养瓶、人外周血淋巴细胞分离液、清洗液、NK细胞基础培养基、因子、1 mL枪头、200 μL枪头、移液枪、15 mL离心管,提前从冰箱取出放置室温。
1. 将新生鼠(1-3天)放到6 厘米细胞培养皿盖上,喷酒精后放置超净工作台中。
2. 在6 厘米培养皿中入2-3 毫升 PBS缓冲液。
3. 将新生鼠的头直接剪下来,放入PBS缓冲液中漂洗掉。
4. 在6 厘米细胞培养皿中加入500-1000 微升 PBS缓冲液。
5. 取脑:用微型剪刀将脑沿中缝剪开脑皮和脑壳沿着开口起始处和终点处两边横向各剪一刀用剪刀将嗅球连接处挑断,把整个脑取出放入刚刚倒好的PBS缓冲液中。
6. 取下丘脑神经干细胞:将整脑翻面,腹面朝上。
下丘脑在整脑中间腹面突出部,沿着一条脑缝切三刀,边缘修整一下后,用镊子夹断2/3处,取上方(即腹面)2/3的脑。
7. 在6 厘米培养皿中加入500 微升 NSC神经干细胞专用消化液,将取好的下丘脑组织块放入其中,用镊子夹住刀片,切碎脑组识,直到没有大的组织块出现即可。.
8. 补1500 微升的NSC神经干细胞专用消化液,将6 厘米培养皿盖上盖子放入培养箱中(37℃)消化20-30 分钟。
9. 消化结束后加入PBS缓冲液稀释消化液,转移到15 毫升离心管中,最终PBS缓冲液的体积为消化液体积的3倍即可。
10. 吹打混匀后,置于离心机2000转,离心15分钟
11. 用泵吸掉上清,尽量吸干净,加入NSC专用培养液(要分多少个孔就加多少毫升)。
12. 吹打混匀后,用40 微米 细胞筛过滤入培养皿中,补2 毫升专用培养液夜即可。
13. 一般一周后分细胞。
细胞传代:悬浮细胞 (6厘米培养皿)
1. 将上清吸入15 毫升管中。
2. 用1毫升 PBS缓冲液润洗2次,加入15 毫升管中。
3. 高心,2000 转,15 分钟 (水平离心机)。
4. 吸去上清,加入500 微升 消化液,放入培养箱中横放5-10 分钟(消化好后,会变成絮状,轻轻吹打则变透明)。
5. 加入1500 微升 PBS缓冲液稀释消化液,吹打几次,至溶液变澄清。
6. 离心,转 rpm,5 分钟。
7. 吸去上清,用新鲜NSC培养基重悬,分盘。
细胞冻存
消化后使用10% DMSO 的神经干细胞专用培养基冻存。
细胞鉴定
1. 形态观察
神经干细胞一般都是悬浮培养的,会形成神经球.
2. 标志物鉴定
小鼠下丘脑神经干细胞经Sox2及Nestin免疫荧光鉴定,纯度可达90%以上。
★ SOX2+≥90%;
★ β-Tubulin + ≤10%,排除神经元细胞;
★ GFAP + ≤10%,排除星胶细胞;
★ GalC或OSP + ≤10%,排除少突胶质细胞
NSCs移植在脑疾病中的作用
目前,神经干细胞移植广泛应用于各种神经系统疾病的治疗研究,在脑疾病的治疗研究中主要包括脑损伤性疾病,各种神经退行性疾病、遗传代谢性疾病等。神经干细胞疗法主要包括直接的细胞替代治疗,以及基因工程化神经干细胞的治疗。颅脑外伤以及各种脑血管意外是脑损伤的主要原因,其共 同特点是局部神经元和胶质细胞的缺失,临床表现为患者的运动、感觉以及认知功能损害,目前尚无有效的方法促进脑神经损伤后神经功能的恢复。神经干细胞移植为改善脑损伤后遗症带来了希望。

NSCs移植在运动神经元疾病中的作用
运动神经元病(MND)是一组病因未明的选择性侵犯脊髓前角细胞、脑干运动神经元、皮层锥体细胞及锥体束的慢性进行性神经变性疾病,主要包括肌侧索硬化症(ALS)、原发性侧索硬化(PLS)和进行性肌肉(SMA)。该病导致运动神经元受损,表现为肌及肌无力,严重者可致死亡,目前尚无对MND的有效治疗方法。
NSCs治疗MND的潜能依赖于其转入宿主体内后的生存、分化和迁移能力,最终引起缓慢的功能改善。
2021年6月,美国西达赛奈医疗中心的一项新的临床试验获得加利福尼亚再生医学研究所 (CIRM)拨款1199万美元,旨在确定使用基因工程干细胞治疗ALS的可行性。

NSCs移植在帕金森疾病中的作用
帕金森病(PD)是由于黑质多巴胺能神经元细胞的丢失造成纹状体多巴胺递质分泌不足而形成的神经退行性疾病。
神经干细胞移植不但可以补充丢失的多巴胺能神经元,而且分泌的神经营养因子可以抑制多巴胺能神经元的丢失,长期有效地改善患者的症状。
通过基因工程将神经营养素基因, 如神经生长因子(NGF)、胶质细胞源性神经营养因子(GONE)等转入神经干细胞,使NSCs分泌功能增加,然后把NSCs移植到脑内,不但可以促进多巴胺能神经元释放多巴胺递质,而且可以为残留的正常多巴胺能神经元提供更多的神经保护。
2021年6月8日,拜耳公司(Bayer)宣布,旗下BlueRock Therapeutics公司在1期临床试验中,成功地将多能干细胞生成的多巴胺能神经元DA01移植给一名帕金森病患者。2021年7月19日,BlueRock公司的DA01项目获得美国FDA的快速通道资格认定。
NSCs移植在脊髓损伤中的作用
脊髓损伤使局部神经元和胶质细胞缺失,神经元轴突脱髓鞘,破坏了上行或下行的神经传导通路。脊髓损伤使损伤部位以F的感觉、运动以及自主调节功能受损。由于NSCs具有生物学特性,利用神经干细胞移植对脊髓损伤部位进行细胞替代和转基因治疗是目前脊髓损伤治疗研究的热点。

推荐产品