应用案例 | 预测化学品烘干工艺的安全性 Part 2
时间:2023-03-13 阅读:669




我们首先使用LFA方法,测得了ABTA干品在25℃下的热扩散系数。在后续热模拟中引用该值,忽略干品与湿品差异、以及热扩散系数随温度的变化。
随后使用DSC方法,测得了干品在5~45℃之间的比热值,更高温度下则使用外推数据。对于湿品,考虑室温下含水量10%,烘干过程中平均含水量5%,高温下水含量为0%,结合水的比热,由质量混合律估算了湿品在多个温度点下的比热值,用于热模拟计算。具体数值详见后文。

DSC在四个不同升温速率(1, 2, 5, 10 K/min)下的分解测试结果如下:

反应包含四个放热峰,总放热量约563.3 J/g。
与干品数据(见后)相比,湿品曲线上多出了100℃前后的放热尖峰。经一些补充测试的对比验证,发现随着样品湿度的下降,该峰会逐渐变小,当湿度 < 5% 时则趋于消失。猜想较多水分的存在,促成了某一不期望的反应,而该反应最终造成湿品在直接烘干的工艺下,发生放热失控乃至出现烧焦现象。
初看起来,该峰的温度很高,即使在1K/min下,温度也在90℃左右,比烘料温度(40--50℃)高出不少,似乎在40...50℃温度下不应产生这一热效应?
但如果仔细观察曲线规律,就会发现升温速率越慢,该峰温度越低。测试所用的升温速率,最慢的是1K/min,这虽然在一般热分析测试来说已经算是“很慢”了,但如果升温速率再下降到0.5K/min,甚至0.2K/min、0.1K/min… 反应温度又会下降到什么程度?从阿伦尼乌斯方程的指数形式可知,很多反应并没有一个明确的“起始温度”,只是温度越低,速率越慢。那么可以想象该反应在40…50℃范围内也在缓慢地发生,如果给予足够长的时间,也可能进行到一定的程度。因此不能仅凭动态升温条件下的DSC曲线所得反应温度较高,就武断地得出在更低温度下反应不可能发生这样的结论。
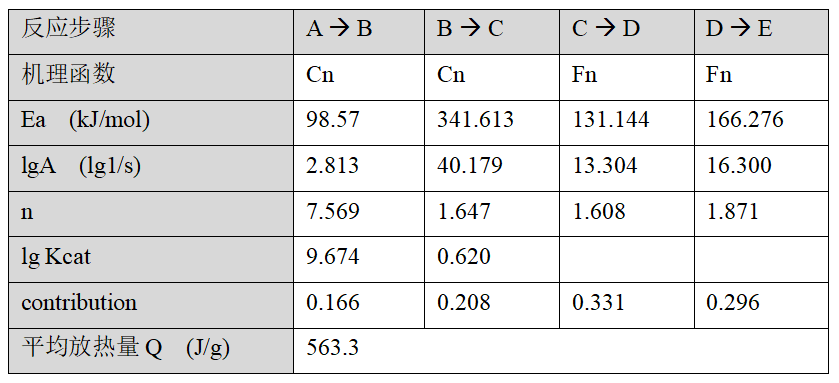
在这三条DSC曲线背后,实际上包含了反应速率与温度和转化率关系的相关信息。现在我们对数据进行动力学建模,本质上是将这些信息收集起来,抽象成描述 (转化率~时间~温度 关系)的数学方程。我们使用了如下的四步反应模型:

即从表观反应物A出发,经过四阶段的反应步骤(对应于DSC曲线上由低温到高温的四个放热峰),最终生成产物E。Cn为自催化机理函数,Fn为级数反应函数,相关数学细节从略。使用该模型的拟合结果如下图:

拟合相关系数97.4%。得到的动力学参数为:
以该动力学模型,对40、45、50℃下等温24小时的反应过程进行预测,结果如下:
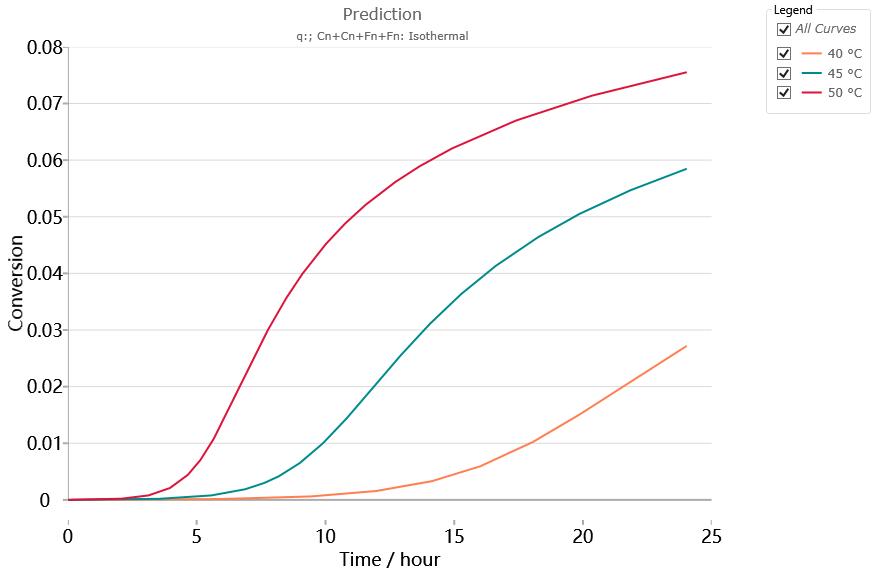
看起来反应似乎比较温和,在40℃下等温24小时,最终达到的转化率为2.7%。即使在50℃下,24小时的最终转化率也仅为7.5%。
但需要注意的是,动力学等温预测,模拟的是温度稳定地控制在目标温度下的反应情况,类似于DSC在理想情况下所能得到的等温测试结果。对应于工艺,相当于物料在反应过程中的反应热被充分移除,物料处于温度稳定状态,没有任何的热蓄积。而真实的情况可能是样品一旦发生放热反应,热量得不到及时而有效的移除,蓄积在物料内部,导致体系温度上升,而温度的上升会进一步加速反应,最终可能发生爆炸式的失控反应。
动力学软件中的绝热预测,验证了这一点,结果显示对于40…50℃的烘料温度,在24小时内均会发生剧烈的两阶段热失控过程,温度越高,过程发生得越早,在绝热的条件下,物料的最终温度将达到将近600℃:

实际烘料过程的温控情况介于理想移热与绝热之间,需要使用热模拟软件,得到更贴合实际的失控过程模拟。
未完待续
作者
徐梁
耐驰仪器公司应用实验室
