大分子蛋白质失稳原因和研究方法
时间:2020-07-01 阅读:1939
蛋白质的稳定性指的是蛋白质抵抗各种因素的影响,保持其生物活力的能力。蛋白质在细胞和生物体的生命活动过程中,起着十分重要的作用。从生物的构成到生物的新陈代谢、遗传都和蛋白质的结构和功能密切相关。生物的结构和性状都与蛋白质有关。因此,合适的表征手段对研究蛋白质变性至关重要。
一、蛋白质失活的原因和机理:
1蛋白水解酶和自溶作用
1.1酶在使用和贮存过程中的失活常是由于微生物和外源蛋白水解酶作用的结果。蛋白水解酶可催化肽键水解。
1.2 当蛋白质底物也是一种蛋白水解酶时,就会发生自我降解现象,叫做自溶。
2 聚合作用
蛋白质发生可逆性伸展——>伸展的蛋白质分子彼此缔合——>可能发生蛋白质分子间二硫键的形成从而使蛋白质沉淀析出。蛋白质的聚合作用和沉淀的区别:蛋白质的聚合作用可能是可逆的,并不一定是不可逆的。沉淀作用意味着蛋白质并未发生显著的构象变化即从溶液中析出。因此沉淀很容易再溶于水溶液宏,并恢复其全部天然特性。
3 pH
pH下引起蛋白质变性的重要因素是:一旦远离了蛋白质的等电点,那么蛋白质分子内相同电荷间的静电斥力会导致蛋白质伸展。从而使埋藏在蛋白质内部非电离残基发生电离,导致失活。pH的变化可以引起蛋白质的伸展,这个过程原则上是可逆的,但这些变化常能导致不可逆的聚合或酶的自溶,引起不可逆失活。
4 氧化作用
各种氧化剂能氧化带芳香族侧链的氨基酸以及蛋氨酸、半胱氨酸和胱氨酸残基,从而使蛋白质变性。分子氧,H2O2和氧自由基是常见的蛋白质氧化剂。
5 表面活性剂和去污剂
表面活性剂在很低浓度下能使蛋白质发生强烈地相互作用,导致蛋白质不可逆变性。其中阴离子去污剂的作用比阳离子和非离子去污剂强烈。
6 变性剂
6.1脲和盐酸胍:机制尚不明确,可能是消除了维持三级结构的疏水作用力或直接与蛋白质分子作用
6.2高浓度盐:高浓度盐既有稳定作用也有变性作用,这要看盐的性质和浓度。
6.3螯合:常常不可逆地失活需要金属辅因子的酶,但可稳定不需要金属辅因子的酶。
6.4有机溶剂改变溶液的介电常数;增加疏水核的溶解度,降低带电表面的溶解度;夺去酶分子表面的必须水而使酶失活。
7 重金属离子和疏基试剂
与蛋白质的疏基、二硫键以及色氨酸、组氨酸残基反应。
8 热
热失活是溶液上经常遇到的酶失活的原因。热失活分两部分:伸展---不可逆失活。
9 机械力
振动、剪切、超声波、压力都可能引起蛋白质的变性。这种变性理论上是可逆的,但也伴随着其他反应而不可逆地失活。
10 冷冻和脱水
冷冻和脱水时,溶质被浓缩,引起酶微环境中pH和离子强度的剧烈改变,减弱疏水相互作用,并可能引起二硫交换和疏基的氧化。
11 辐射作用:
辐射可产生自由基(·OH,H2O2,O2-等)直接或间接地作用于蛋白质分子。
二、蛋白质失活的研究方法
案例1 组氨酸对蛋白的保护作用

Turbiscan多重光散射仪(静态多重光散射)
用Turbiscan多重光散射仪测量高浓度蛋白溶液中的平均粒径来监测蛋白质的聚集。该技术分析了蛋白质的自然形态与时间的关系,且无需稀释。10 wt%浓度的牛血清白蛋白蛋白(BSA)分散于水中,在60℃下分析20h。

蛋白粒径与组氨酸含量的关系(左:粒径vs时间 右:粒径@20hvs组氨酸浓度)
讨论:增加组氨酸浓度可使蛋白直径保持较低且更接近其原始状态而不发生变性。多重光散射技术测量过程无需稀释,可以在原位状态下表征蛋白质的聚集变性过程,是比较科学的研究失稳过程的方法。
案例2 辐射对蛋白质稳定性的影响
2018年Chengliang Li等学者利用Turbscan(静态多重光散射)研究了辐射对SP肌浆蛋白和MP肌肉蛋白的物理稳定性的影响。不同辐照剂量0, 3, 5 and 7 kGy的TSI不稳定性指数在3h内的变化曲线如下图所示。
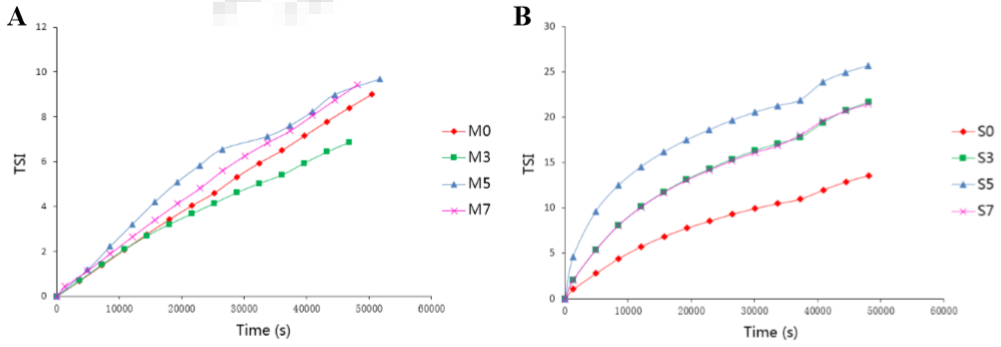
TSI稳定性指数随时间变化关系(左:MP肌肉蛋白 右:SP肌浆蛋白)
为了表征蛋白质失稳过程的弹性和粘性性变化,Chengliang Li利用Rheolaser Master(动态多重光散射)评价了不同辐射剂量蛋白的微流变性。

Rheolaser Master光学法微流变仪
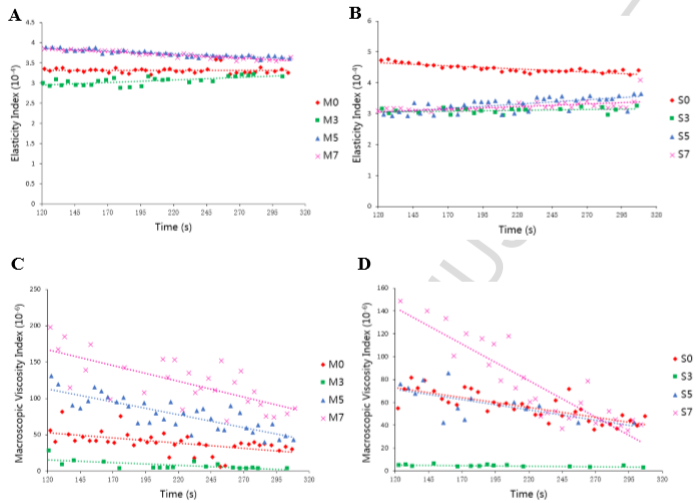
微流变性随时间变化关系(A MP肌肉蛋白弹性 B SP肌浆蛋白弹性 C MP肌肉蛋白粘性 D SP肌浆蛋白粘性)
讨论:对于MP肌肉蛋白而言,辐射剂量≥5kgy时的TSI高于辐射剂量3kgy的TSI,但是差距不大,MP的物理稳定性随辐射剂量变化不明显。这与微流变数据(A和C)有比较好的对应关系。另外,与SP对照组相比,辐射后的SP样品的TSI显著升高,说明SP可能聚集并形成蛋白质聚合物
Li C , He L , Ma S , et al. Effect of irradiation modification on conformation and gelation properties of pork myofibrillar and sarcoplasmic protein[J]. Food Hydrocolloids, 2018, 84(NOV.):181-192.
案例3 Rheolaser Crystal表征BSA蛋白的热稳定性

Rheolaser Crystal相变分析仪
热分析是表征蛋白热稳定性的基本方法之一,多年以来一直广泛应用于科研和工业中。近年来在各个领域,特别是高分子材料领域,都有了长足发展。差示扫描量热法(DSC)是应用广泛的热分析技术之一。相变分析仪(Rheolaser Crystal)与DSC应用方向类似,可以表征蛋白质的凝胶点,但是由于相变分析仪采用DWS技术,直接从颗粒的纳米级运动速度获取数据,因此对于结构变化具有更加灵敏的相应。
蛋白受热变性性示意图
下图展示了用Rheolaser Crystal与DSC测量的2%BSA pH 4, 15mM NaCl水溶液的凝胶点。
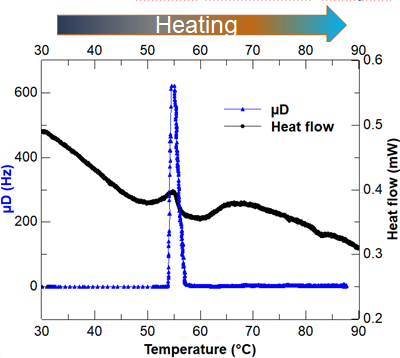
BSA蛋白的在升温过程中的凝胶点(蓝色:相变分析仪数据 黑色:DSC数据)
讨论:两个测试技术的凝胶点基本一致。DSC由于基线并不平整,热的流量曲线在凝胶点附近出现的峰比较小,容易被忽略。而Rheolaser Crystal的峰非常清晰明了地指示了BSA的凝胶点,由于测量方法的优势,Rheolaser Crystal不需要考虑样品的状态固体,粉末,液体,对样品制样要求不高,样品量多少对测试结果影响不大。
结论:多重光散射技术是一种非常可靠的表征蛋白质失稳过程的仪器,采用静态多重光散射技术的Turbiscan适合测量蛋白在原位状态下的粒径/微观结构变化过程;采用动态多重光散射技术的Rheolaser Master和Rheolaser Crystal分别用于表征蛋白变质过程中的粘弹性变化过程和蛋白热稳定性。
结晶分析仪 Rheolaser Crystal
Rheolaser Crystal用于研究样品微观结构的转变过程,仪器基于先进的微流变学原理对样品进行热力学分析,监测所有物理现象:结晶、融化、多晶形态转变等。Rheolaser Crystal与Rheolaser Master类似,同样采用DWS多散斑扩散光谱学。入射的激光被样品中的颗粒散射,产生干涉,利用高速摄像机捕捉散斑图像。散斑图像变换的速度直接与颗粒的运动速度相关,颗粒运动越快,散斑变化速度越快。

