1、肺纤维化模型
大鼠肺纤维化模型
SD大鼠,鼠龄6-8周龄,体重200g左右,气管内给药。称重大鼠,麻醉后将大鼠仰卧固定于实验台,切开颈部的皮肤,钝性分离颈部的肌肉,充分暴露气管,行气管切开术,模型组(BLM组)缓慢注人5 mg/kg BLM 0.1mL,立即旋转动物,使药液在肺内均匀分;对照组同上方法注入生理盐水0.1 ml,分笼饲养,自由饮水。期间动物会出现背毛凌乱,体重减轻现象,会有少量死亡现象。
模型鉴定
造模14天后,可进行肺部CT观测。
HE与MASSON肺组织病理检测观察
小鼠肺纤维化模型
成年雄性ICR小鼠,体重25-28g,气管内给药。称重小鼠,麻醉后将小鼠仰卧固定于实验台,切开颈部的皮肤,钝性分离颈部的肌肉,充分暴露气管,行气管切开术,模型组(BLM组)缓慢注人5 mg/kg BLM 50 μl,立即旋转动物,使药液在肺内均匀分;对照组同上方法注入生理盐水50 μl,分笼饲养,自由饮水。期间动物会出现背毛凌乱,体重减轻现象,会有少量死亡现象。
2、溃疡性结肠炎模型
小鼠溃疡性结肠炎模型
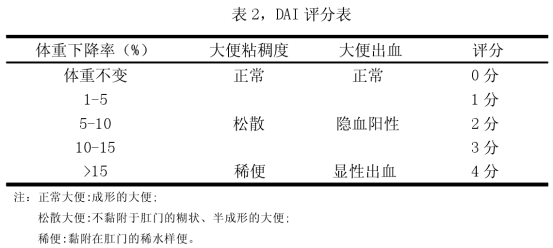
6-8周雄性C57BL/6小鼠,予3%DSS常饮法造模,给DSS14天(小鼠每只/天饮水量大约是5ml),构建小鼠结肠炎模型。在 UC 造模期间,每天称取小鼠体重,观察小鼠粪便稠度及出血情况,进行 DAI评分,分别就体重降低、粪便稠度、出血三个参数计算 DAI,DAI=(体重评分+粪便稠度评分+出血评分)/3
(a)体重减少%=[-(实验当天的体重-原始体重)/原始体重*100,0分≤1%,
1 分=1%-5%,2 分=5%-10%,3 分=10%-15%,4 分≥15%];
(b)粪便稠度(0 分:粪便正常,2 分:粪便稀松,4 分:腹泻);
(c)出血(0 分:阴性未发现,出血情况,2 分:阳性发现出血情况,4
分:发现严重出血情况).
大鼠溃疡性结肠炎模型
雄性Wistar 大鼠200-230g,予5%DSS常饮法造模,给DSS14天,构建小鼠结肠炎模型。在 UC 造模期间,每天称取大鼠体重,观察大鼠粪便稠度及出血情况,进行 DAI评分,进行 DAI评分,分别就体重降低、粪便稠度、出血三个参数计算 DAI,DAI=(体重评分+粪便稠度评分+出血评分)/3
(a)体重减少%=[-(实验当天的体重-原始体重)/原始体重*100,0分≤1%,
1 分=1%-5%,2 分=5%-10%,3 分=10%-15%,4 分≥15%];
(b)粪便稠度(0 分:粪便正常,2 分:粪便稀松,4 分:腹泻);
(c)出血(0 分:阴性未发现,出血情况,2 分:阳性发现出血情况,4
分:发现严重出血情况).
3、慢性心衰模型
大鼠慢性心衰模型
Wistar雄性大鼠200g-250g,适应性喂养1周后,阿霉素腹腔注射给药2.5mg/kg/周,连续给药6周,超声心电图记记录以下血流动力学参数:心率(HR)、左室收缩压(LVSP)、左室舒张末压(LVEDP)、舒张压(DAP)、收缩压(SAP)、平均动脉压(MAP)、左室压力最大上升及下降速度(±dp/dtmax)进行测定。
小鼠慢性心衰模型
体重在25-30g之间的雄性C57BL/6J小鼠,适应性喂养1周。小鼠在建立模型前8小时禁止饮水及进食,每一只小鼠都要称体重并记录下体重值,模型组给予盐酸阿霉素 (辉瑞制药有 限公 司)腹腔注射 ,2mg/kg,前 5次每 3d注射1次, 以后每 7d注射 1次 ,累计用量 22mg/kg。给药10周。采用超声心动图检测小鼠心脏功能:心率(HR)、左室收缩压(LVSP)、左室舒张末压(LVEDP)、舒张压(DAP)、收缩压(SAP)、平均动脉压(MAP)、左室压力最大上升及下降速度(±dp/dtmax)。
4、癫痫模型
大鼠癫痫模型
9周龄健康雄性SD大鼠,海马区脑立体定位注射20 mM海人酸1μl构建癫痫模型,注射海人酸后即可观察大鼠行为,观察时间是4h。海人酸注射大鼠发生的痫性发作按Racine分级标准进行判定:0级,无惊厥;I级,咀嚼、眨眼、立须等面部肌肉抽搐;II级,以点头运动为主的颈部肌肉抽搐;III级,单侧前肢阵挛、抽搐;IV级,双侧前肢阵挛、抽搐伴身体立起;V级,双侧后肢强直,身体背曲强直,跌倒伴全身阵挛。0级为正常,I-III级为癫痫部分性发作,IV~V级为癫痫大发作;凡在观察时间内连续出现3次IV~V级发作者即为成功癫痫模型。
小鼠癫痫模型
8-10周健康雄性C57BL/6小鼠,将小鼠置于立体定位仪上,根据预实验摸索并优化麻醉剂用量、海人酸注射量和注射部位的各参数,得到以大脑Bregma为原点的海马定位注射坐标:-2.0、-1.8、-2.3 mm(右侧海马),进行单侧注射海人酸12 mg/kg后,观察其行为表现。以在急性期出现持续l h以上的III 级以上发作,即为成功癫痫模型。
5、帕金森模型
大鼠帕金森模型
选取雄性 SD 大鼠 ,体质量 250 ~300 g,进行脑立体定位手术,麻醉后,将大鼠头部固定于脑立体定位仪,颅骨暴露出 2 点,脑黑质坐标:(1)anterior-posterior(AP): 5.2 mm; medial-lateral (ML): 1.9 mm; deep ventral(DV): 8.2 mm, (2) AP: 5.5 mm; ML: 2.4 mm; DV: 7.6 mm,并注入药物,正常对照组每侧注入含0.2%抗坏血酸 0.9%氯化钠注射液 3 μl,6-OHDA 处理实验组每侧注入浓度为 2.5mg/ml 的6-OHDA 溶液3 μl(溶剂为含0.2%抗坏血酸 0.9%氯化钠注射液)。
鉴定:(1)大鼠经 6-OHDA 损毁两周后,在黑暗安静的环境下腹腔注射 APO 溶液(1mg·kg-1),单独置于笼内,观察其行为变化,5min 后开始计算旋转圈数,以向
健(左)侧、首尾相接、环曲 360°者计一圈,记录 5min,若旋转>7r·min-1 或>35r·5min-1(*毁损)视为建模成功;旋转<7r·min-1 或<35r·5min-1(部分毁 损)及 15min 无旋转或向右侧旋转者均视为建模失败;(2)HE染色观察脑组织病理学变化
小鼠帕金森模型
C57BL / 6 雄性小鼠,8 周龄,体质量 20 ~ 22 g,小 将动物固定在立体定位仪(上,沿颅 顶矢状缝切开皮肤,暴露前囟( Bregma)。 在前囟前 (AP)+0. 5 mm,中线旁(ML) -2. 0 mm(右侧) 打孔。 微量进样器缓慢下行,先后分别在 颅骨下(DV)-3. 0 mm 和-2. 0 mm 各注入 6-OHDA 溶 液 0. 78 μL,速度 0. 5 μL·min-1 ,每次注射完成后需 留针 3 min。 匀速退出进样器,缝合处理创面。
鉴定:术后的 5 周中,每周腹腔注射 0. 125 g·L-1 的 APO(0. 5 μg·g-1 )观察动物旋转情况。 将动物放置在 500 mL 的烧杯里,杯底附新鲜干燥垫料,计数 30 min 内,小鼠向未损伤侧的旋转圈数,每旋转 360 度记为 1 圈。 统计结果以旋转次数(rotation·30 min-1 )表示。
6、糖尿病模型
大鼠二型糖尿病模型
8周龄雄性SD大鼠(200g左右),用高脂高糖饲料喂养4周后禁食12小时,腹腔注射配制好的链脲佐菌素溶液30 mg/kg,连续注射3天。4天后检测空腹血糖值,当空腹血糖≥ 11.1mmol/L时,并且高血糖持续两周且无恢复现象者可作为成功模型。
小鼠二型糖尿病模型
C57BL/6 雄性小鼠(20g左右),用高脂高糖饲料喂养4周后禁食12小时,腹腔注射配制好的链脲佐菌素溶液30 mg/kg,连续注射3天。4天后检测空腹血糖值,当空腹血糖≥ 11.1mmol/L时,并且高血糖持续两周且无恢复现象者可作为成功模型。
参考文献
[1]Xiong Y, Nie D, Liu S, et al. Apoptotic PET Imaging of Rat Pulmonary Fibrosis With [18F]ML-8. Mol Imaging. 2018;17:1536012118795728. doi:10.1177/1536012118795728
[2]Zhou Y, Li P, Duan JX, et al. Aucubin Alleviates Bleomycin-Induced Pulmonary Fibrosis in a Mouse Model. Inflammation. 2017;40(6):2062-2073. doi:10.1007/s10753-017-0646-x MLA
[3]Cao H, Liu J, Shen P, et al. Protective Effect of Naringin on DSS-Induced Ulcerative Colitis in Mice. J Agric Food Chem. 2018;66(50):13133-13140. doi:10.1021/acs.jafc.8b03942
[4]Zhu L, Gu P, Shen H. Protective effects of berberine hydrochloride on DSS-induced ulcerative colitis in rats. Int Immunopharmacol. 2019;68:242-251. doi:10.1016/j.intimp.2018.12.036
[5]Sun X, Chen G, Xie Y, et al. Qiliqiangxin improves cardiac function and attenuates cardiac remodelling in doxorubicin-induced heart failure rats. Pharm Biol. 2020;58(1):417-426. doi:10.1080/13880209.2020.1761403
[6]马琴. 阿霉素诱导大鼠慢性心力衰竭模型的制备[J]. 生物化工, 2019, 005(004):P.100-103.
[7]靳文英, 乔正国, 郑春华,等. 蛋白激酶C结合蛋白1参与心力衰竭小鼠心脏去甲肾腺素转运蛋白的表达下调[J]. 中华心血管病杂志, 2014, 42(3):219-224.
[8]Klee R, Brandt C, Töllner K, Löscher W. Various modifications of the intrahippocampal kainate model of mesial temporal lobe epilepsy in rats fail to resolve the marked rat-to-mouse differences in type and frequency of spontaneous seizures in this model. Epilepsy Behav. 2017;68:129-140. doi:10.1016/j.yebeh.2016.11.035
[9]张玉奇, 刘卫平, 王彦刚,等. 不同剂量海人酸海马注射建立大鼠颞叶癫痫模型的实验研究[J]. 山西医科大学学报, 2010, 41(005):383-386.
[10]Venceslas D, Corinne R. A Mesiotemporal Lobe Epilepsy Mouse Model. Neurochem Res. 2017;42(7):1919-1925. doi:10.1007/s11064-017-2239-3
[11]何婷婷. 构建海人酸诱导的内侧颞叶癫痫小鼠模型[J]. 基础医学与临床, 2011, 31(7):820-826.
[12] Zhu Y, Wang B, Tao K, et al. Iron accumulation and microglia activation contribute to substantia nigra hyperechogenicity in the 6-OHDA-induced rat model of Parkinson's disease. Parkinsonism Relat Disord. 2017;36:76-82. doi:10.1016/j.parkreldis.2017.01.003
[13]韩文迪. 基于脑微透析技术的大鼠中枢左旋多巴药动学研究及帕金森病大鼠模型的建立[D]. 福建医科大学, 2011.
[14] 于燕, 王可, 贾军,等. 纹状体注射不同剂量6-OHDA制备帕金森病小鼠模型的评价[J]. 首都医科大学学报, 2015(02):255-261
[15]DAD Magalhães, Kume W T , Correia F S , et al. High-fat diet and streptozotocin in the induction of type 2 diabetes mellitus: A new proposal[J]. Anais da Academia Brasileira de Ciências, 2019, 91(1).
[16]蔡羽. 桑瓜饮干预2型糖尿病大鼠的作用及其PI3K/Akt信号通路机制研究[D]. 湖北中医药大学.
[17]STZ加高脂饲料诱导糖尿病C57小鼠成模情况及稳定性的观察研究[J]. 中医眼耳鼻喉杂志, 2015(5):22-25.
[18]]叶桂林, 王清清, 杨文杰,等. 高脂饲料联合STZ诱导建立长期稳定2型糖尿病小鼠模型的给药方案研究[J]. 南昌大学学报(医学版), 2018, 058(002):P.9-13.






