近日,北京大学工学院黄建永课题组在Nature Communications上在线发表了题为“Geometric constraint-triggered collagen expression mediates bacterial-host adhesion”的研究论文。本文基于多功能单细胞显微操作系统FluidFM的单细胞力谱技术(Single cell force spectrum,SCFS)研究细菌与宿主细胞界面力学相互作用,并进一步定量表征了细菌与宿主细胞间的特异性粘附力,建立了细菌与宿主细胞单层相互作用的力-化学耦合模型,从力学生物学视角揭示了空间几何约束诱导细菌与宿主细胞异质性粘附的时空动态规律,在此研究基础上得出,有效抑制宿主细胞表面特异性粘附受体的表达可能会最大限度地减少细菌与宿主细胞之间的生物力学粘附,从而促进细菌的抗生素治疗。这一点对于提高抗生素效力,避免临床误用具有至关重要的意义。
文中所使用的多功能单细胞显微操作系统FluidFM的单细胞力谱技术,可在单细胞水平上提供高质量的力学数据,具有操作简单、适用细胞种类多、通量高、力学范围宽等优势,为本文生物力学的研究提供了关键的数据支撑。
多功能单细胞显微操作系统FluidFM
【研究背景】
细菌与宿主细胞之间的物理接触和随后的粘附是细菌感染的先决条件,由于高致病性细菌和耐药细菌的存在,细菌感染已成为世界范围内对人类健康严重的威胁之一。在细菌-宿主相互作用中,细菌首先借助于各种物理化学因子到达宿主表面,可能通过粘附素和细胞受体实现特异性粘附。一些细菌甚至在随后的过程中内化到宿主细胞中,从而保护它们免受宿主免疫系统和抗生素的攻击。越来越多的证据表明,细菌和宿主细胞的物理微环境,包括但不限于界面粘附力、细胞外基质(ECM)刚度和几何约束,在调节它们的功能和行为中起着关键作用,从而影响细菌和宿主细胞之间的各种相互作用。例如,细菌粘附力作为致病力的一个重要因素,可以促进细菌毒素的传播。机械生物学的新进展已经揭示了ECM的刚性通过细胞骨架重塑调节细菌-宿主相互作用和细菌内化。此外,在伤口愈合、细胞迁移和肿瘤形成等各种生物过程中普遍存在的宿主细胞的几何约束被发现介导细胞形态、细胞-ECM粘附和细胞-细胞相互作用。据报道,组织形态发生和肿瘤进展本质上是由细胞牵引力和细胞间收缩应力之间的竞争调节的。同样,细菌-宿主相互作用涉及复杂的生物物理相互作用,其中病原体可以操纵宿主细胞的机械转导以促进传播,而宿主细胞可能改变其防御策略以消除病原体。尽管在细菌宿主中存在着复杂的机械感应和机械转导相互作用与周围微环境,宿主细胞的空间几何约束是否以及如何触发它们的功能反应来调节与致病菌的物理相互作用仍然是一个谜。
【研究结果】
本文中科研团队首先建立了一个典型细菌的体外模型,如金黄色葡萄球菌和大肠杆菌,感染上皮细胞,如IEC-6细胞(大鼠小肠上皮细胞系6)和HaCat细胞(人角化细胞细胞系),借助成熟的微接触打印技术,允许致病菌感染生长在空间受限的细胞外基质上的宿主细胞单层。作者证明,由于宿主单层上存在二维(2D)几何约束,细菌与宿主之间存在显著的空间异质性相互作用。利用基于流体力显微镜FluidFM技术及单细胞力谱(SCFS),作者量化了细菌和几何限制的宿主单层之间的粘附力,从而揭示了这些力本质上是空间位置和基质刚度相关的。利用单细胞RNA测序(scRNA-seq)和(MC)模拟,作者进一步阐明了由几何约束触发的边缘效应导致的宿主单层中胶原IV的异质表达在调节空间异质细菌-宿主粘附中起关键作用。最后,作者发现胶原IV抑制剂不仅可以有效减少异质粘连,而且可以作为抗生素佐剂来增强抗生素效力。
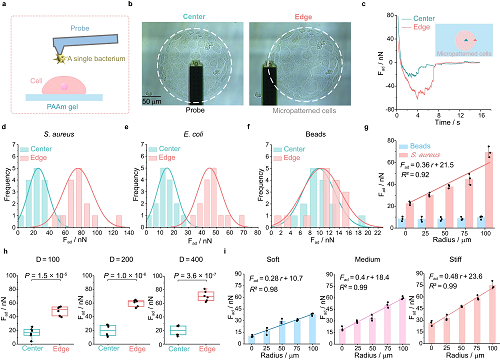
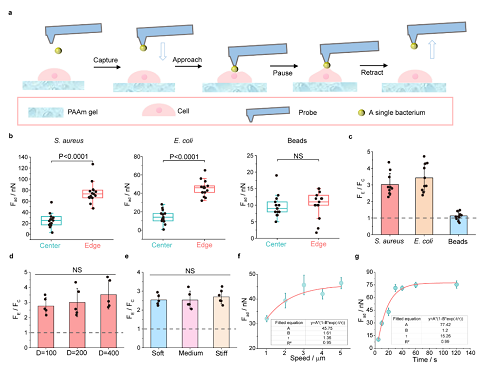
图1. 利用基于FluidFM的SCFS定量表征单个细菌与微图案宿主细胞单层之间的粘附力
【研究意义】
生活在几何受限微环境中的细胞普遍存在于各种生理过程中,例如伤口愈合。然而,宿主细胞的空间几何约束是否以及如何调节细菌与宿主的相互作用仍不清楚。本文研究团队揭示了细菌与空间受限的细胞单层之间的相互作用表现出强烈的空间异质性,细菌倾向于粘附在受限制的单层外缘附近的这些细胞上。细菌粘附力在微图纹单分子膜边缘的粘附力可达75nN,是中心粘附力的3倍,这取决于底层基质的刚性。单细胞RNA测序实验表明,具有显著边缘效应的IV型胶原在空间上的异质表达与位置依赖性细菌粘附有关。在此基础上,研究团队在动物实验中发现,IV型胶原蛋白抑制剂可以作为佐剂来减少细菌粘附,从而显著提高抗生素的疗效。本文详尽的工作不仅阐明了空间几何约束微环境调控细菌-细胞界面粘附的力学生物学机制,也为抗生素辅剂的筛选和临床上改善细菌抗生素治疗方案提供了可借鉴的思路和策略。
【研究利器】
FluidFM技术在单细胞水平上提供高质量的力学数据
本文中FluidFM技术被用于对单细胞的黏附力进行测量。根据细菌和微球的大小(直径1 μm, Sigma),选择开口(直径300 nm)和弹簧常数(0.6 N/m)的FluidFM悬臂探针。悬臂梁灵敏度(S, m/v)用Sader方法标定。探针被0.1 mg/ml PLL-g-PEG包被20min,以减少非特异性细胞结合,然后在纯净水中洗涤5分钟。在细胞力谱实验中,通过施加负压(- 200 mbar)将单个细菌紧紧固定在悬臂开口处。然后,带有单个细菌的悬臂梁以1 μm/s的压电速度接近选定的细胞,并在达到设定值(100 nN)时暂停30s与细胞相互作用。最后,以1 μm/s的压电速度收回悬臂梁,获得粘附力数据。
图2. 细菌-宿主细胞的界面力学相互作用
FluidFM技术的主要优势:
1. 技术可在单细胞水平上提供高质量的力学数据
2. 技术具有通量高、力学范围宽等优势,可直接抓取或者压细胞。
3. 适用细胞种类:悬浮细胞、贴壁细胞均可测量
4. 力学范围:nN到μN级别的细胞水平的力
5. 操作简单:区别于AFM细胞力学测量,具有简便、直接的优势。
【参考文献】
[1] Y. Feng, S. Wang, X. Liu, Y. Han, H. Xu, X. Duan, W. Xie, Z. Tian, Z. Yuan, Z. Wan, L. Xu, S. Qin, K. He, J. Huang. Geometric constraint-triggered collagen expression mediates bacterial-host adhesion. (2023) Nature Communications.
[2] W. Chen, O. Guillaume-Gentil, P. Yde Rainer, C. G. Gäbelein, W. Saelens, V. Gardeux, A. Klaeger, R. Dainese, M. Zachara, T. Zambelli, J. A. Vorholt, B. Deplancke. Live-seq enables temporal transcriptomic recording of single cells. (2022) Nature.
[3] Y. Cui, X. Lyu, L. Ding, L. Ke, D. Yang, M. Pirouz, Y. Qi, J. Ong, G. Gao, P. Du & R.I. Gregory. Global miRNA dosage control of embryonic germ layer specification. (2021) Nature.
[4] Y. Guo, F. Mei, Y. Huang, S. Ma, Y. Wei, X. Zhang, M. Xu, Y. He, B.C. Heng, L. Chen & X. Deng. Matrix stiffness modulates tip cell formation through the p-PXN-Rac1-YAP signaling axis. (2021) Bioactive Materials.
[5] O. Guillaume-Gentil, R.V. Grindberg, R. Kooger, L. Dorwling-Carter, V. Martinez, D. Ossola, M. Pilhofer, T. Zambelli & J.A. Vorholt. Tunable Single-Cell Extraction for Molecular Analyses. (2016) Cell.