引言
大型多细胞系统的实时成像是现代生物学研究中的一个重要挑战。传统显微镜技术在提供高分辨率三维图像方面常有不足,尤其是对于需要最小光毒性的深层样本。开发开放式多样本双视角光片显微镜在这一领域取得了显著进展。本文探讨了这一创新显微镜系统的功能和应用。
肠类器官
利用光片显微镜对模拟肠道上皮的复杂结构——肠类器官进行成像,追踪细胞动态和分化过程。显微镜详细展示了数天内的隐窝和绒毛形成,为细胞周期动态和类器官内不同细胞类型成熟提供了见解。


图一:
a.表达hGem-mVenus和hCdt1-mCherry的肠类器官(左),染色显示溶菌酶(Lys)和DLL1(中)。
b.表达hCdt1-mCherry的肠类器官的最大投影图(MIP),叠加了反向追踪细胞的轨迹,以时间进行颜色编码。虚线对应于z投影。
c.对肠类器官的检测1、检测2及融合数据的z投影,叠加了反向追踪细胞的轨迹,显示时间进程。
d.肠隐窝的放大图,星号表示同时阳性表达hCdt1、Dll1和溶菌酶的细胞。
e.单个细胞的hCdt1、溶菌酶和Dll1强度随时间的定量分析:阳性隐窝细胞(e);
f.阳性绒毛细胞(f)和阳性隐窝细胞(g)。

图二:
e) 对在最后时间点位于隐窝中的三重阳性细胞(hCdt1、Dll1和溶菌酶)的hCdt1强度随时间的量化。每种颜色代表一个单细胞(n = 4)。
f) 对在最后时间点位于绒毛中的hCdt1阳性细胞的hCdt1强度随时间的量化。每种颜色代表一个单细胞(n = 7)。
g) 对在最后时间点位于隐窝中的hCdt1阳性细胞的hCdt1强度随时间的量化。每种颜色代表一个单细胞(n = 9)。
文中对表达FUCCI2的肠类器官进行了活体成像,并进行了终点固定和免疫荧光评估其细胞类型组成。通过3D配准将最后一个活体成像时间点与染色后的类器官叠加,使用Paneth细胞标记溶菌酶(Lys)和分泌细胞标记Dll1来检测感兴趣的细胞。三重阳性细胞(hCdt1+/Lys+/Dll1+)被反向追踪以监测Paneth细胞的成熟及其在G0/G1期的细胞周期停滞。成熟Paneth细胞的初始位置预测了类器官隐窝的最终位置。
接下来,比较了隐窝中的hCdt1+/Lys+/Dll1+ Paneth细胞与hCdt1+/Lys−/Dll−细胞(主要是肠干细胞)和类器官绒毛中的细胞(主要是肠细胞)。进一步识别了那些在记录开始前已经终末分化的肠细胞和Paneth细胞。对于其他细胞,特别是在隐窝中的细胞,确定了它们出现的时间,从而能够追踪它们的完整成熟过程,固定时的平均细胞周期长度为21.9小时。评估细胞类型特定的出现时间,得出结论,Paneth细胞比单阳性hCdt1细胞出现得更早,表明特定的细胞周期长度和特定的分化顺序。这种对细胞行为和成熟过程的洞见在没有活体成像和免疫荧光结合整个类器官体积的情况下是无法实现的。
胚状体
胚状体是模拟早期胚胎发育的三维干细胞聚集体。光片显微镜捕捉到这些致密结构的单细胞分辨率图像,揭示了细胞运动和形态变化。追踪胚状体内单个细胞的能力突显了光片显微镜在研究动态发育过程中的应用潜力。


图三:
h. 表达Lck-GFP的胚体在三个时间点(42小时Wnt前期,66小时Wnt中期和90小时Wnt后期)的z平面图像。
i. 在h中部分突出显示的胚体细胞,分别为种植后42小时、66小时和90小时。箭头指示细胞的突起。
j. 使用Cellpose软件对种植后42小时的Lck-GFP阳性细胞进行的3D代表性分割。
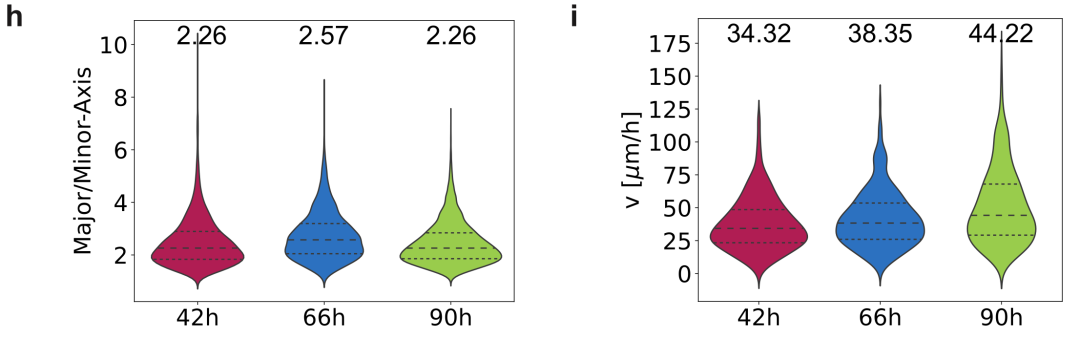
k. 比较种植后42小时、66小时和90小时的细胞长轴和短轴的比率,图中显示了中位数、第一和第三四分位数。
l. 胚体的最大投影图(MIP),叠加了随时间追踪的细胞。
m. 细胞速度(μm/h)的小提琴图,以观察窗口分组,图中显示了中位数、第一和第三四分位数。
n. 在42小时、66小时和90小时种植后拍摄的胚体细胞轨迹,中心对齐到坐标系原点,并以颜色编码表示时间进程。
o. 在各个成像窗口中,Lck-GFP胚体细胞的轨迹长度。细胞速度(μm/h)的分组小提琴图,图中显示了中位数、第一和第三四分位数。
p. Lck-GFP嵌合胚体在各个成像窗口中,所有细胞的平均均方位移(m.s.d.)。比例尺:50 μm(a–d, h, j, l);20 μm(i)。
图四:
h) 对悬浮状态下成像的胚体在三个不同时间窗口中长轴和短轴比率的比较。测量在每个成像窗口(42小时、66小时或90小时)内的3个胚体的3D体积上进行,共33个时间点。分别对3753个数据点(42小时)、3340个数据点(66小时)和8861个数据点(90小时)进行了分析。图中显示了中位数、第一和第三四分位数。
i) 胚体发育过程中在三个不同时间窗口内成像的细胞速度的小提琴图,显示了中位数(图中数值)及第一和第三四分位数。每个观察窗口中追踪的数据点数量(来自3个单独的胚体)如下:n = 622(42小时),n = 562(66小时),n = 539(90小时)。胚体在悬浮状态下成像。
与其他样本不同,胚状体是密集结构,因此难以单细胞分辨率成像。文中使用这个模型系统展示显微镜获取单个细胞运动和形态特征的能力。标准胚状体实验方案使用Wnt激活剂(Chiron99021)以提高中胚层形成效率。这可能会诱导类似上皮-间质转化的行为并增加细胞迁移。为了分析胚状体内的细胞形态,文中生成了嵌合体,其中一部分细胞(约10%)表达膜报告基因(Lck-GFP)。记录胚状体在Wnt脉冲前、中和后的动态。此外,将胚状体嵌入40%的Matrigel中,以防止样本腔室中的机械旋转。使用Cellpose对单个细胞进行3D分割,从而计算长轴/短轴比率,显示细胞伸长在Chir处理期间达到峰值。
后期阶段,部分细胞显示出较长的细胞突起。这一观察结果提出了细胞运动性在胚状体发育过程中增加的假设。使用Fiji插件Mastodon,追踪了Lck-GFP阳性细胞,发现迁移的中位速度在胚状体发育过程中增加。在Wnt脉冲期间,迁移速度的中位数增加了1.4倍。Wnt激活后成像的胚体展示了最长的轨迹长度。对3D均方位移的评估表明,从90小时开始追踪的细胞速度增加,并且迁移行为发生了变化。这些发现共同表明,迁移增加,提示Wnt激活增强了细胞运动性并可能在胚体中促进了协调迁移。观察到的细胞形态变化和运动性增加,部分表明了类似上皮-间质转化的过程。这一趋势在嵌入Matrigel中的胚体和悬浮状态下的胚体之间保持一致。
开放式多样本双视角光片显微镜
设计和特点
开放式多样本双视角光片显微镜结合了双重照明和双重检测镜头,以实现多角度的高分辨率成像。其主要特点包括:
双重照明和检测
系统采用两个相对的照明镜头和两个检测镜头,从不同方向捕捉图像。这种配置最小化了伪影,特别适用于厚大标本的高质量成像。
开放式设计
这种设计允许从顶部轻松访问样本,便于在成像过程中进行样本操作和添加试剂。
多孔安装系统
可定制的多孔样本支架使得多样本的高通量成像成为可能,这对于需要并行处理和比较的实验至关重要。

相较传统显微镜的优势
高通量和低光毒性
光片显微镜通过薄光片照明样本,固有地减少了光毒性,这对于长期的实时成像至关重要。双视角设置在保持低光曝光的同时进一步提升了图像质量。多孔系统允许同时成像多个样本,与传统显微镜方法相比显著提高了通量。
详细的单细胞分析
显微镜的高分辨率和双视角功能使得在大而厚的样本中进行详细的单细胞分析成为可能。这一特性对研究异质生物过程尤其有价值,因为需要在长时间内观察细胞行为和相互作用。
灵活性和定制化
开放式设计和可定制的样本支架提供了处理不同类型样本和实验设置的灵活性。这种适应性使显微镜适用于从类器官研究到发育生物学和癌症研究的广泛生物学研究。
开放式多样本双视角光片显微镜代表了实时成像技术的重大进展。未来的增强可能包括整合自适应光学以进一步提升图像质量,以及结合激光消融或光遗传刺激技术以在成像过程中操纵样本。此外,该系统处理光学透明标本的能力可能扩展其在深层组织成像中的应用。
开放式多样本双视角光片显微镜的开发和成功应用标志着生物成像领域的关键一步。通过在长时间内提供大型多细胞系统的高分辨率三维图像,这一技术为理解细胞水平上的复杂生物过程开辟了新的途径。
阅读原文:
Moos, F., Suppinger, S., de Medeiros, G. et al. Open-top multisample dual-view light-sheet microscope for live imaging of large multicellular systems. Nat Methods 21, 798–803 (2024).
参考文献:(上下滑动查看更多)
相关产品

