First to share information on new modality therapies and intelligence for drug discovery.
2024年SITC大会上,康宁杰瑞(Jiangsu Hengrui Pharmaceuticals)公布皮下注射抗体药物偶联物JSKN033的临床数据(NCT06226766,JSKN033-101)。
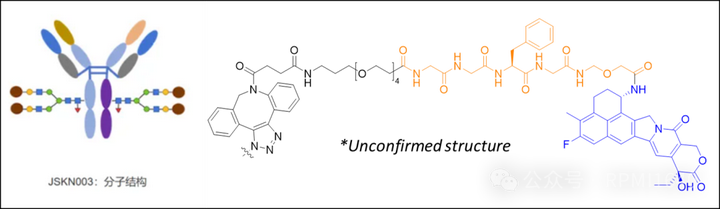
JSKN033由JSKN003和恩沃利单抗(KN035)组成,是一种高浓度皮下注射联合制剂。JSKN003为靶向HER2双表位的糖基定点抗体偶联药物,DAR值为4;KN035是由人源化PD-L1单域抗体和人IgG1 Fc片段组成的Fc融合蛋白,于2021年11月在中国获批准上市,是皮下注射PD-(L)1抑制剂。
据披露,JSKN033复方制剂未采用透明质酸酶作为药物扩散剂(不同于Enhertu的皮下版本技术),其创新技术的高浓度配方可在几秒钟内注射,相比于需要5-15分钟的SC透明质酸酶输注,JSKN033显得更加便捷。JSKN033-101:ADC皮下注射的临床突破JSKN033-101是一项开放、多中心、Ⅰ/Ⅱ期试验,旨在评估JSKN033单药治疗HER2表达晚期实体瘤(IHC≥1+)或HER2突变的非小细胞肺癌(NSCLC)患者的安全性、耐受性和初步有效性。最新数据显示,截至2024年10月14日,Ⅰ期剂量递增阶段研究共入组11例患者,分5个剂量组接受每周1次JSKN033单药治疗,最高剂量设置为6.7mg/kg。有效性方面,10例疗效可评估患者中,3例患者出现部分缓解(PR),5例患者疾病稳定(SD),疾病控制率(DCR)达80%:JSKN033在4.5mg/kg剂量水平下即表现出抗肿瘤活性。其中2例患者接受5.6mg/kg剂量水平治疗:1例为HR+/HER2-乳腺癌(BC)患者,既往接受过≥4线的抗肿瘤治疗,另外1例为HER2突变的NSCLC患者,既往IO、化疗和HER2-TKI治疗后进展;1例患者接受6.7mg/kg剂量水平治疗,为既往接受过白蛋白结合型紫杉醇和放疗的三阴乳腺癌(TNBC)患者。至数据截止日期,7例患者仍在治疗中。安全性方面,最常见的治疗相关不良事件(TRAEs)是注射部位反应,均为1级,且通常在无需任何治疗、或仅接受抗组胺药物后的2周内自行缓解;未观察到剂量限制性毒性 (DLT)。尽管JSKN033展现了良好的安全性,但考虑到ADC类药物的潜在积蓄毒性,仍需等待更多数据来进一步评估其长期安全性。
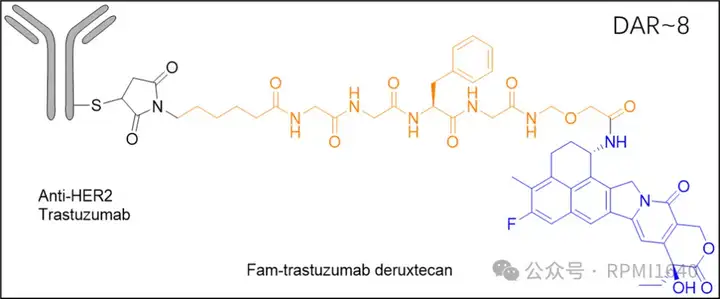
3亿美元合作:皮下Enhertu除了JSKN033外,皮下给药ADC的其他创新形式也在不断涌现。2024年11月10日,韩国生物技术公司Alteogen宣布与第一三共达成合作,开发皮下给药的Enhertu制剂(trastuzumab deruxtecan+ALT-B4)。
根据协议,阿斯利康将向Alteogen预付2000万美元,以及后续2.8亿美元的开发和商业里程碑付款,交易总额为3亿美元。利用其透明质酸酶(ALT-B4)平台,帮助Enhertu实现更高效的皮下吸收。ALT-B4采用了Hybrozyme™技术,可以通过暂时水解皮下的透明质酸,增加药物的吸收速度和分散性,从而减少局部积聚和不良反应。据悉,这项技术可将Enhertu的注射时间从30分钟缩短至5分钟内。
皮下给药相比静脉给药有许多优点,比如注射时间更短、提高患者依从性、减少住院次数和降低医疗成本。静脉给药长期使用可能会导致血管损伤和增加感染风险,皮下制剂有望减少这些并发症。皮下注射给药要求抗体在高浓度下保持较高的稳定性,对药物的亲疏水性、稳定性、粘度等有很高要求。而ADC本身三元结构的复杂性导致其很难在高浓度下保持稳定,此外,药物分子量大、难以通过皮肤或肌肉组织快速进入血液循环,以及可能导致淋巴系统毒性和注射部位局部积累等问题,均是ADC皮下制剂的开发需要面临解决的难点。
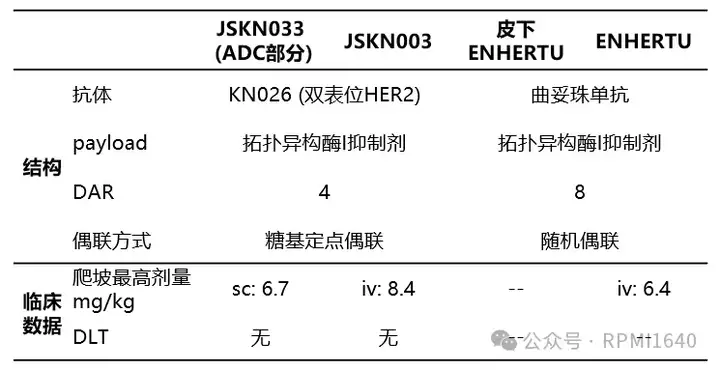
对JSKN033与ENHERTU结构及相关临床数据等进行对比:JSKN033(JSKN003)与ENHERTU在linker裂解点及毒素方面保持一致,但在药物抗体比率(DAR)和偶联方式上存在差异。仅就DAR值而言,JSKN033的DAR=4,相较于DAR=8,理论上具有更高的亲水性。高DAR的ADC具有更强的疏水性,与此同时带来的是可能的皮下聚集现象,该现象可能会导致直接毒性。此外,偶联技术上,糖基定点偶联由于其药物均一性和可能更好的疗效及更低的副作用,可能更适合用于需要精确控制药物释放和分布的皮下注射。JSKN033在SITC 2024披露的临床I/II期剂量爬坡中,最高给药剂量达6.7 mg/kg,这一数据在JSKN003、DS8201早期iv给药临床剂量爬坡中分别为8.4、6.4 mg/kg。JSKN033披露的安全性数据在所有剂量下未观察到DLT,最常见的TRAEs为注射部位反应,均为1级,提示JSKN033兼具亲水性及安全性。
2023年,艾伯维在JMC上发布的对皮下给药ADC进行的改造研究,试图通过对linker和载荷的改造,以克服ADC的疏水性,从而便于开发皮下给药的ADC。
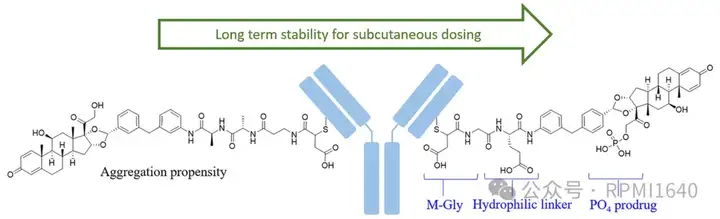
艾伯维的研究基于ABBV-3373,该药物是由抗TNF抗体阿达木单抗(adalimumab)与糖皮质激素受体调节剂(GRM)组成的新型ADC,linker为MP-Ala-Ala (maleimide-propionamide- Ala-Ala),DAR值为4, 临床用于治疗类风湿关节炎(RA)和其他免疫介导疾病,目前该药物已经完成了II期概念验证临床。
艾伯维通过改造linker和载荷的亲水性,首先将linker的MP改造为M-Gly,然后通过在载荷上引入磷酸基团来进一步降低疏水性。改造后的ADC在药效上与ABBV-3373相似,但在高浓度下的聚集问题并未解决。进一步的,缩短linker为两个氨基酸形成DL12,同时将linker中的Ala替换为更亲水的Glu并形成DL13,进一步降低了linker-载荷的疏水性。改造后的ADC在疏水性、黏度和稳定性方面的表现与裸抗相比有所改善,尤其是在疏水性较低的ADC17和ADC19中。在疗效检测中,不同ADC药物表现出相近的疗效。艾伯维的研究表明,通过增强ADC的亲水性可以显著降低ADC的聚集问题,但过度亲水性可能会适得其反,因此,在设计皮下给药型ADC时,须综合考虑。
2023年,海德堡在AACR大会中介绍了皮下给药作为ATACs(Amatoxin-based Antibody-Drug Conjugates)一种潜在的给药途径。该途径被认为可以改善ATACs的治疗指数(TI),同时提高患者的耐受性。
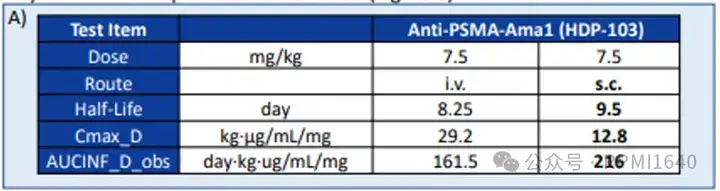
ATACs是海德堡经典的以amanitins为载荷的偶联物平台。使用半胱氨酸反应性和位点特异性amatoxin作为载荷,以靶向PSMA的HDP-103在猴子和小鼠的临床前研究中进行了单剂量ATACs静脉或皮下注射。数据显示,与静脉注射相比,皮下注射ATACs能够延长半衰期、降低最大血药浓度(Cmax),但总暴露量(AUC)相近。这表明,ATACs的毒性可能主要与Cmax相关,而治疗效果则更多依赖于AUC。因此,皮下注射有望提高ATACs的治疗指数(TI)。当然,这个结论能否推演到其他payload的ADC有待商榷。
ATACs中进展较快的是HDP-101。HDP-101是进入临床试验的ATAC,正在开展一项针对多发性骨髓瘤患者的I/II期临床试验(NCT04879043),给药方式采用静脉注射。2024年4月的AACR会议上公布了该研究的阶段性结果,PR=11.1%;随后,在同年11月的ASH会议上更新的数据表明,PR=10.5%,但出现3例DLT。
鉴于amanitins载荷的亲水理化特性和海德堡之前的探索,或许可以期待HDP-101在皮下给药做出进一步尝试。