趋化因子及其受体的功能

免疫细胞的定向迁移是机体免疫应答发生和完成的必须条件。趋化因子是一类控制细胞定向迁移的细胞因子。其功能行使由趋化因子受体介导。趋化因子与其受体的相互作用控制着各种免疫细胞在循环系统和组织器官间定向迁移, 使之到达感染、创伤和异常增殖部位, 执行清除感染源、促进创伤愈合和消灭异常增殖细胞、维持组织细胞平衡的功能。趋化因子及其受体的表达和功能异常,将导致免疫细胞不能在正确的位置行使正确的功能。因此趋化因子系统在免疫系统功能行使的各个环节中处于关键地位,并由此在病原体的清除、炎症反应、病原体感染、细胞及器官的发育、创伤的修复、肿瘤的形成及其转移、移植免疫排斥等方面都起着重要的作用。以趋化因子及其受体分子为控制靶点,通过激活或拮抗趋化因子受体的信号传导来调控趋化因子系统的功能,可望用于控制和治疗相关疾病。
- 趋化因子与趋化因子受体
趋化因子是一类能趋化细胞定向移动的小分子分泌蛋白,由70至100个氨基酸组成。至今已发现了40多种人的趋化因子,属细胞因子中的zui大家族。当成纤维细胞、内皮细胞、表皮细胞等组织细胞和免疫细胞在受到刺激物如生长因子、干扰素、病毒产物及细菌产物的诱导时可分泌出不同的趋化因子。在趋化因子的分子中都有4个保守的半胱氨酸(C)。根据靠近分子氨基端(N端)的前两个C间是否插入其它氨基酸, 将它们分为4个亚类:CXC类(插入1个氨基酸残基),亦称为α类趋化因子,如IL-8(Interleukin-8);CC 类(不插入其它氨基酸残基),又称为β类趋化因子, 如MCP-1(Monocyte chemoattractant protein-1);CX3C类(插入3个其它氨基酸),如Fractalkine;C类(N端仅1个C),如Lymphotactin 。目前所发现的趋化因子主要属于α类和β类。在分子结构上,皆通过二硫键折叠成以自由的N-端、三个反向折叠的β-片层和α螺旋的羧基端(C-端)为特征的二级结构。
趋化因子受体是一类介导趋化因子行使功能的GTP-蛋白偶连的跨膜受体(GPCR),通常表达于免疫细胞、内皮细胞等细胞膜上。分子由约330个氨基酸组成。7个跨膜区将分子分成细胞外自由的N-端、3个细胞外环、3个细胞内环和C-端几个部分。胞内第二环是与异三聚体G-蛋白偶连的部位,有特征的天门冬氨酸-精氨酸-酪氨酸盒(DRY box)氨基酸序列。与趋化因子受体偶连的异三聚体G-蛋白的α亚基为Gi/o,对百日咳毒素敏感。按趋化因子的分类, 将同CC 类趋化因子结合的受体称为CC类受体(CCR), 同CXC类趋化因子结合的受体称为CXC 类受体(CXCR),同样有C和CX3C受体(CR、CX3CR)。
趋化因子N-端氨基酸残基的缺失突变体不能与其受体结合, 证实了趋化因子的N-端序列在与受体结合及引起信号转导中的关键作用。C端能够极大地增强N端肽段的信号转导功能。1st -beta片层结构能够和血管内皮细胞上的氨基葡聚糖GAG(Glycosaminoglycan)结合, 可使其附着并富集于血管内皮细胞上。趋化因子受体胞外区的N端及一个以上的胞外环参与其配体的结合, 而且N端的序列在很大程度上决定了受体对趋化因子的特异选择性。趋化因子受体的C端(胞内部分)大都为富含丝氨酸(Serine)和苏氨酸(Threonine)残基的片段,其磷酸化可能参与受体活化后的信号传导和内化。
在配体-受体结合实验中, 可以看到趋化因子与受体间结合的冗余现象, 即一个趋化因子可与数个趋化因子受体结合,如RANTES(Regulated on activation normal T cell expressed and secreted)与CCR1、CCR3、CCR5的结合;一个趋化因子受体可与数个趋化因子结合,如CCR3 与eotaxins , MCP-2 、3 、4 、RANTES的结合。因此, 在体外趋化实验中表现为。一种趋化因子可以趋化表达不同趋化因子受体的免疫细胞做定向迁移,一种免疫细胞可以为多种趋化因子所趋化。正是这种趋化因子及其受体相互作用的冗余才使趋化因子系统在体内的精细调控成为可能。在体内,各种趋化因子通过它们在组织中不同时相的表达和分布差异, 以及趋化因子受体在不同免疫细胞类群上不同时相的表达和分布差异, 调控着不同免疫细胞的定向迁移和相互作用, 并由此决定了趋化因子与其受体作用的特异性。如IL-8主要作用于中性粒细胞的定向迁移;CXCR3、CCR5的表达局限在T辅助1型细胞(TH1)上,由INF-gamma可诱导产生的MIG(Monokine induced by INF-γ)、IP-10(INF-γinducible protein of Mr 10 000)及I-TAC(INF-inducible T cell αchemoattractant)主要分布在TH1型炎症组织中;CCR3,CCR4,CCR8 则局限在T辅助2型细胞(TH2)上;TARC(Thymus- and activation-related chemokine)表达于皮肤血管内皮上,向皮肤组织聚集的T细胞表达其受体CCR4;小肠固有层血管内皮表达TECK(Thymus-expressed chemokine),在肠炎组织中有表达其受体CCR9的T细胞浸润。
- 趋化因子对免疫细胞的趋化作用
趋化因子的基本功能就是对表达有相应趋化因子受体的细胞的定向趋化作用。目前认为, 免疫细胞克服血管内皮细胞屏障,在体液和组织间穿行包括4个步骤, 即细胞随体液流动、细胞被稳固黏附到血管内皮上、细胞穿过内皮细胞间隙、细胞迁移到特定组织中。在此过程中, 趋化因子控制着渗出细胞的选择性以及被选择细胞的稳固黏附。体外实验已证实趋化因子能使在血流速度下的淋巴细胞黏附在固相支持物上, 不同的趋化因子特异地引导表达相应趋化因子受体的淋巴细胞的附着。免疫细胞由于所表达的选择素与血管内皮细胞上的选择素受体的相互作用,与血管内皮有瞬间的非选择性的可逆性黏附,因此免疫细胞在血流中沿血管壁做滚动前行。局部组织中血管内皮细胞所分泌的趋化因子通过内皮细胞上的GAG被富集在血管内皮表面。表达相应趋化因子受体的免疫细胞在滚动前行中由于与血管内皮上趋化因子作用而促使免疫细胞整合素的上调,整合素与内皮细胞上的黏附分子的相互作用导致免疫细胞不可逆地黏附到血管内皮表面。稳固黏附的免疫细胞在其分泌的特殊酶的作用下,穿过内皮细胞间隙和基底膜,并在趋化因子浓度梯度的引导下,移行至特定组织中。
- 趋化因子与天然免疫
研究表明, 趋化因子具有直接抑菌作用。趋化因子MIG、IP-10及I-TAC在体外抑菌实
验中具有防御素样的直接抑菌作用。经IFN-γ刺激PBMC所产生的MIG、IP-10及I-TAC是非刺激细胞的28 ~ 35倍, 在琼脂扩散实验中能够抑制大肠杆菌和李斯特菌的生长。而且, 与防御素相同,该抑菌作用受高浓度NaCl的抑制。另外,人β-防御素是趋化因子受体CCR6
的配体,能趋化表达CCR6的未成熟树突状细胞(Dendritic cell ,DC)和记忆性T细胞的定向迁移, 由此可以推测,天然免疫因子β-防御素通过与CCR6的相互作用, 招募DC和T细胞到达微生物感染部位, 是启动获得性免疫应答的途径之一。
- 趋化因子与获得性免疫
4 .1抗原提呈与T、B 细胞活化
DC是目前发现的功能zui强的抗原提呈细胞(Antigen presenting cell ,APC)。DC从外周组织迁移到周围淋巴组织伴随着其抗原提呈过程亦即DC的成熟过程。趋化因子通过作用于具有不同趋化因子受体表达谱的DC,控制和调节DC完成其迁移过程。未成熟DC表达多种趋化因子受体, 在感染和创伤组织中不同的趋化因子的招募下进入损伤组织,在进行抗原摄取和处理的过程中, 由不表达CCR7 的未成熟DC 转变为高表达CCR7的成熟DC(mDC),使之能在表达于输入淋巴管高内皮静脉(HEV)和次级淋巴组织中的副皮质区(T-区)的趋化因子SLC ELC (Secondary lymphoid tissue chemokine Epstein-Barr virus-induced receptor ligand chemokine)的引导下,从周围组织进入二级淋巴组织中。同样, 幼稚T细胞亦高表达CCR7。与mDC一样,受HEV和周围淋巴组织中SLC/ELC的引导进入淋巴结的副皮质区(T-区域), 并在此接受APC提呈的抗原信息而被激活成效应T细胞。效应T细胞离开淋巴结并经血液循环游走到外来抗原部位启始特异性免疫反应。幼稚(Naive)B细胞亦高表达CCR7和CXCR5,受SLC/ELC和表达于周围淋巴组织浅皮质区的BCA-1(B cell-activating chemokine-1)的引导,通过HEV进入淋巴结并定位于浅皮质区(B细胞区域)而被活化。
4 .2 T 细胞的极化
T 细胞极化成TH1或TH2代表着T 细胞应答的重要特征。环境中的细胞因子类型决定了T细胞极化的方向。IL-12、INF-α促使幼稚T细胞极化成TH1细胞;IL-4则促使稚T细胞极化成TH2细胞;而TGF-β能够促使幼稚T细胞发展成TH0细胞,后者具有被极化成TH1细胞或TH2细胞的潜能。极化的T细胞表达不同的趋化因子受体, 从而使不同的T细胞被趋化到不同的*位,发挥不同的生物学功能。TH1细胞特征表达CCR5、CXCR3,受趋化因子如MIP-1α(Macrophage inflammatory protein-1α)、RANTES、MIG 和IP-10 的驱使到达损伤组织, 并能表达上述趋化因子以募集更多的淋巴细胞,引起TH1型炎症反应;TH2细胞特征表达CCR3、CCR4、CCR8,可以受趋化因子如eotaxin-1、2、3, MCP-2、3、4的驱使而到达损伤组织,引发TH2型炎症反应。趋化因子能通过诱导TH0细胞定向分化来调节前炎性细胞因子与抗炎细胞因子的平衡。MIP-1α与活化的T细胞孵育可导致向TH1的极化,增加IFN-γ的表达水平,下调IL-4的水平;而MCP-1与活化的T细胞孵育后则导致向TH2的极化,增加IL-4的水平,下调IFN-γ水平。zui近还发现, IP-10、MIG、I-TAC既是TH1细胞特征表达的趋化因子受体CXCR3的激动剂,同时又是TH2表达的趋化因子受体CCR3的天然拮抗剂,这一事实表明通过CXCR3招募TH1细胞的趋化因子做为CCR3的拮抗剂,又能阻断CCR3的趋化因子对TH2细胞的招募。因此,趋化因子能促使不同极化T细胞的募集。
4 .3病原体的清除
免疫活性细胞到达病原体感染部位是免疫系统进行抑制和清除病原体的先决条件。机体对结核分支杆菌的感染所产生的细胞免疫反应需要巨噬细胞和T细胞聚集到感染部位。CCR2基因敲除小鼠在结核分支杆菌感染的早期就会死亡, 其感染肺部组织中细菌数量是正常感染小鼠的100倍,在感染早期和晚期皆可观察到巨噬细胞和DC及T细胞积聚到感染肺部的数量大大减少,表明CCR2及其相应趋化因子在启始和控制结核分支杆菌感染中的重要作用。
- 趋化因子的其他功能
趋化因子远非仅仅是zui初认为的机体的免疫调节因子,还明确地具有除调节免疫细胞迁移以外的其它功能, 如一些趋化因子是细胞生长调节因子,一些是血管生成调节因子,一些则参与胚胎期免疫系统、循环系统和中枢神经系统的形成和发育,还有一些趋化因子受体是一些病原体入侵宿主细胞的受体。这些发现将趋化因子及其受体的重要作用扩展到参与免疫系统功能以外的生物学功能之中。
5 .1调节血细胞发育
趋化因子系统以多种方式来调节血细胞的发育。*,可以调节造血干细胞和血细胞前体的增殖。体内外实验证实,有几种趋化因子如MIP-1α、IL-8 ,能够抑制正常血细胞前体的增殖,并有协同作用。由于这种抑制作用能够保护造血细胞免受抗肿瘤药物导致的对细胞周期中造血前体细胞的毒性作用,MIP-1α的类似物BB10010做为治疗乳腺癌化疗中血细胞减少的药物进入Ⅱ期临床试验。SDF-1能促进人外周血CD34+前体细胞的增殖,增强人骨髓、脊柱血及小鼠脊柱中造血干细胞的生存和抗凋亡能力, 增强体外长期培养小鼠造血干细胞的植入能力。第二,可以调节造血干细胞和血细胞前体的迁移和归巢。在SDF-1/CXCR4基因敲除小鼠上观察到骨髓中造血前体细胞而非胎肝中造血前体细胞减少, 表明SDF-1在胚胎发育中造血干细胞和前体细胞从胎肝向骨髓的迁移中起决定性作用。第三,调节淋巴细胞发育中淋巴细胞的迁移和归巢。许多趋化因子组成性地表达于胸腺组织、周围淋巴结和其它淋巴组织中,选择性地招募表达有相应趋化因子受体的幼稚淋巴细胞,使得胸腺及周围淋巴组织能够发育正常。这些趋化因子被称为归巢趋化因子(Homing chemokines)。如在胸腺组织中表达有趋化因子TECK、ELC、SLC、MIP-3α等, 在二级淋巴组织中表达有ELC 、SLC、DCCK-1(Dendritic cell chemokine-1)、BCA-1等,招募幼稚T细胞和B 细胞分别进入各自的发育成熟部位。
5 .2参与胚胎期器官的发育
SDF-1/CXCR4基因敲除小鼠死于子宫内,伴有严重的心室隔膜缺损,小脑组织结构发育异常,胃肠道的血管发育异常,显示它们在器官发育中的重要作用。
5 .3趋化因子与血管生成
在CXC类趋化因子中,就其CXC 前至N-端是否存在ELR(Glu-Leu-Arg)序列将之分为2个亚类, 即ELR+-CXC 和ELR-CXC。ELR+-CXC 类趋化因子,如IL-8、MGSA(Melanoma growth-stimulatory activity), 能趋化培养的内皮细胞定向移动, 并能增强家兔角膜新生血管的数量, 因此具有促血管生成作用;而ELR-CXC类趋化因子,如IP-10、MIG、PF4(Plaet factor 4),则具有抑制血管生成作用, 它们在体外趋化试验中能够拮抗ELR+-CXC 类趋化因子对内皮细胞的趋化作用,并抑制ELR+-CXC类趋化因子的促家兔角膜血管生成作用。促血管生成功能在促进创伤的愈合和肿瘤的生长中有重要作用。
5 .4趋化因子受体与病原微生物感染
5 .4 .1疟原虫受体
疟原虫入侵红细胞是通过红细胞上的Duffy 抗原受体(Duffy antigen receptor for chemokines,DARC)介导。DARC是红细胞上能够结合多种趋化因子的趋化因子受体,是发现的*个可以和不同类趋化因子结合(如可以和CC类的MCP-1、RANTES及CXC类的IL-8、MGSA结合)的趋化因子受体,但不能引发信号转导。在功能上可能是血液中的趋化因子池,以吸收并调节血液循环中过量的趋化因子。
5 .4 .2 HIV的辅助受体
HIV感染宿主细胞除需要细胞上的CD4为受体外, 还需要趋化因子受体做为其辅助受体才能实现。HIV首先与宿主细胞上的CD4 结合,进一步与相应的趋化因子受体CCR5或CXCR4结合,zui终导致HIV核酸穿膜进入宿主细胞。主要的辅助受体是CCR5 和CXCR4。由于分离时病毒所利用的辅助受体的差别,将HIV分为嗜巨噬细胞株(M-株)和嗜T细胞株(T-株), 前者主要侵染细胞表面表达有CCR5的巨噬细胞,后者主要侵染细胞表面表达有CXCR4的T淋巴细胞。通常在初始感染者上分离到的HIV都是M-株。由于HIV的高变异性,在持续感染一段时间后,从感染者身上还可以分离到能够利用其它的趋化因子受体的
HIV,如CCR2、CCR3、CXCR2等。参与辅助受体功能的结构主要是趋化因子受体的N-端、胞外区的一些部位,它们与其趋化因子结合区域有部分交叉重叠。
5 .5 趋化因子对组织细胞及肿瘤细胞的趋化作用
趋化因子除了对免疫细胞有定向趋化作用外,对其它能够表达相应趋化因子受体的组织细胞都具有趋化作用。如前面提到的ELR-CXC类趋化因子对内皮细胞的趋化作用。SDF-1对胚胎期神经细胞的趋化能力使之在中枢神经系统神经网络的发育中起重要作用。长期以来一直有报道,在肿瘤组织中有趋化因子和趋化因子受体的表达,包括肿瘤细胞和浸润细胞。但趋化因子对肿瘤的发生和发展的正向或负向作用是多方面的和不确切的。一些趋化因子通过激活免疫活性细胞毒性细胞或抑制肿瘤相关血管生成来抑制肿瘤的生长和发展。而另一些趋化因子则通过促肿瘤细胞增生、移行,促进蛋白水解酶的分泌和诱导血管生成来促进肿瘤的发展。在不同的研究中, 不同的趋化因子有不同的作用,或相同的趋化因子也有不同的作用, 表明在肿瘤的形成和发展中趋化因子网络的参与是复杂的。肿瘤的转移是一种非随机的、有组织器官选择性的高度组织化的过程,与淋巴细胞的定向迁移有相似之处。已有实验证实肿瘤细胞的转移受趋化因子的严格调控。与正常乳腺细胞和乳腺组织相比,在乳腺癌培养细胞、乳腺癌组织和乳腺癌转移瘤上有高表达CCR7和CXCR4。CCR7的配体SLC/ELC表达于HEV和周围淋巴组织中,CXCR4的配体SDF-1主要表达于淋巴结、肺、肝及骨髓, 而在小肠、肾、大脑和骨骼肌中痕迹量表达。乳腺癌转移特征正是向周围淋巴结、骨髓、肺及肝脏转移, 极少至肾脏。在体外实验中,相应趋化因子对乳腺癌细胞有趋化作用和诱导浸润作用;体内实验表明, 抗CXCR4的单抗能够阻止乳腺癌细胞转移至淋巴结和肺组织。同样,在黑色素瘤的组织特异性转移与肿瘤细胞上表达的趋化因子受体CXCR4、CCR7 和CCR10 有关。因此趋化因子及其受体在决定肿瘤转移目地组织中有重要作用。
- 结语
趋化因子及其受体的上述生物学功能的研究和揭示使之成为当今zui有前途的治疗炎症性疾病的靶点。趋化因子及其受体相互作用的多渠道方式可能意味着细胞在移行的每一步骤都依赖于单个的趋化因子或趋化因子受体, 阻断这一受体可导致该移行细胞移行方向的改变, 所以在许多趋化因子受体拮抗剂的实验研究中可以看到, 往往单个趋化因子的阻断就能明显地抑制炎症反应。不同的淋巴细胞在趋化因子的作用下选择性地移行到特定的部位,提示阻断趋化因子受体策略较目前所使用的免疫抑制剂更具选择性和安全性。目前已在制备各种趋化因子受体拮抗剂, 有单克降抗体、趋化因子变异体和小分子有机化合物。在未来的几年中很有可能就会从中筛选到治疗免疫相关疾病的有效药物。
相关通路指标:
Chemokine Ligands:
α Chemokine (CXC Motif): CXCL1 (IL8RA), CXCL10 (INP10), CXCL11 (I-TAC/IP-9), CXCL12 (SDF1), CXCL13, CXCL14, CXCL16, CXCL2 (IL8RB), CXCL3, CXCL5 (ENA-78/LIX), CXCL6 (GCP2), CXCL9 (MIG).
β Chemokine (CC Motif): CCL1 (I309), CCL11 (Eotaxin), CCL13 (MCP-4), CCL14, CCL15 (MIP-1D), CCL16 (HCC4), CCL17 (TARC), CCL18 (PARC), CCL19, CCL2 (MCP-1), CCL20 (MIP-3A), CCL21 (MIP-2), CCL22 (MDC), CCL23 (MPIF-1), CCL24 (Eotaxin 2), CCL25 (TECK), CCL26 (Eotaxin 3), CCL27, CCL28, CCL3 (MIP-1A), CCL4 (MIP-1B), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (MCP-2).
γ Chemokine (C Motif): XCL1, XCL2.
δ Chemokine (CX3C Motif): CX3CL1.
Chemokine Receptors:
α Chemokine (CXC Motif): CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6.
β Chemokine (CC Motif): CCR1, CCR10, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9.
γ Chemokine (C Motif): XCR1.
δ Chemokine (CX3C Motif): CX3CR1.
Atypical: ACKR2, ACKR4, CCRL2, ACKR3, DARC.
Cytokines Involved in Chemotaxis: C5, CKLF, CMTM1 (CKLFSF1), CMTM2 (CKLFSF2), CMTM3, CMTM4, IL16, IL1B, IL4, IL8, PF4V1, PPBP, TNF.
Cytokine Receptors Involved in Chemotaxis: CR1 (GPR77), CMKLR1, FPR1, GPR17.
Other Genes Involved in Chemotaxis: HIF1A, SLIT2, TLR2, TLR4, TYMP.
通路研究工具:
癌症炎症因子和免疫衰减系列 | PCR Array of Cancer Inflammation & Immunity Crosstalk | HU-CIIC-084 |
趋化因子受体系列 | PCR Array of Chemokines & Receptors | HU-CHKR-084 |
克罗恩病系列 | PCR Array of Crohn's Disease | HU-CD-084 |
树突状抗原呈递细胞系列 | PCR Array of Dendritic & Antigen Presenting Cell | HU-DAPC-084 |
G蛋白偶联受体系列 | PCR Array of G Protein Coupled Receptors | HU-GPCR-084 |
炎性细胞因子及受体系列 | PCR Array of Inflammatory Cytokines & Receptors | HU-ICR-084 |
炎症反应和自身免疫系列 | PCR Array of Inflammatory Response & Autoimmunity | HU-IRA-084 |
PCR Array:
 Q-PCR array是信号通路基础生物学研究和临床疾病研究的重要工具。这种功能分类芯片运用成熟的SYBR Green荧光定量PCR技术,专注于一个信号通路中基因的表达水平检测。与传统的高密度表达谱芯片相比,Q-PCR array具有针对性强、灵敏度高、准确可靠等优点。 芯片上的基因包括了与研究对象有确定关系的基因,或至少是与研究对象的关系有待考证的基因。如果研究对象是某一生物学通路的基因,则使用针对该类基因的功能分类基因芯片比使用高密度表搭配芯片更加有效便利。
Q-PCR array是信号通路基础生物学研究和临床疾病研究的重要工具。这种功能分类芯片运用成熟的SYBR Green荧光定量PCR技术,专注于一个信号通路中基因的表达水平检测。与传统的高密度表达谱芯片相比,Q-PCR array具有针对性强、灵敏度高、准确可靠等优点。 芯片上的基因包括了与研究对象有确定关系的基因,或至少是与研究对象的关系有待考证的基因。如果研究对象是某一生物学通路的基因,则使用针对该类基因的功能分类基因芯片比使用高密度表搭配芯片更加有效便利。
BioTNT QPCR芯片特点:
l 灵敏度高,样本使用量低;
l 线性范围广,可同时检测表达水平差异大的基因;
l 每个基因的检测引物优化后保证高扩增率和产物单一;
l 重复性高,Ct值的平均差异只有0.25个循环;
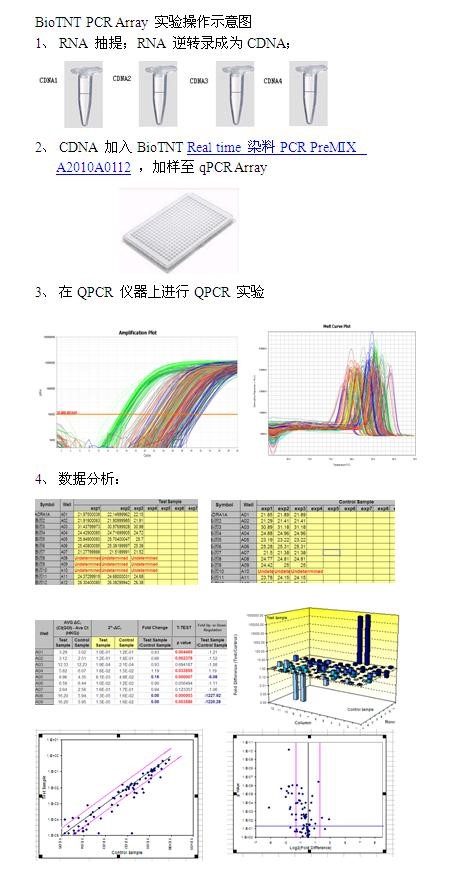
BioTNT QPCR Array芯片操作流程: