10187ES Plant Tissue PCR Kit (With Dye)
该企业相似产品
企业简介
翌圣生物科技(上海)股份有限公司【Yeasen Biotechnology (Shanghai) Co., Ltd.】是一家以蛋白质改造和酶进化技术为驱动,聚焦生命科学产业链上游核心原料,从事分子、蛋白和细胞三大品类生物试剂的研发、生产与销售的高新技术企业,通过打通分子酶、蛋白、抗体、核酸、细胞的技术开发路径,成为国内少数同时覆盖三大品类生物试剂、兼备核心技术自主研发能力和规模化生产能力的高新技术企业,产品广泛应用于生命科学研究领域、诊断与检测领域和生物医药领域。
主营业务
公司凭借在蛋白质改造和酶进化领域的技术优势和深耕生物试剂行业多年积累的丰富经验,构建了品质优良、类型齐全、种类丰富的产品管线。自公司成立以来,公司研发、生产和销售的生物试剂超过3000种,涵盖分子、蛋白、细胞三大品类的生物试剂,能够满足客户多种类型生物试剂的一体化采购需求。公司核心产品覆盖qPCR系列、NGS系列、逆转录系列、核酸提取与纯化系列、PCR系列、分子克隆系列、体外转录系列、抗体、蛋白纯化系列、蛋白分析系列、重组蛋白、细胞分析系列、细胞培养系列、细胞转染系列、报告基因检测系列等多个品类的生物试剂,广泛应用于生命科学研究、诊断检测和生物医药等领域。
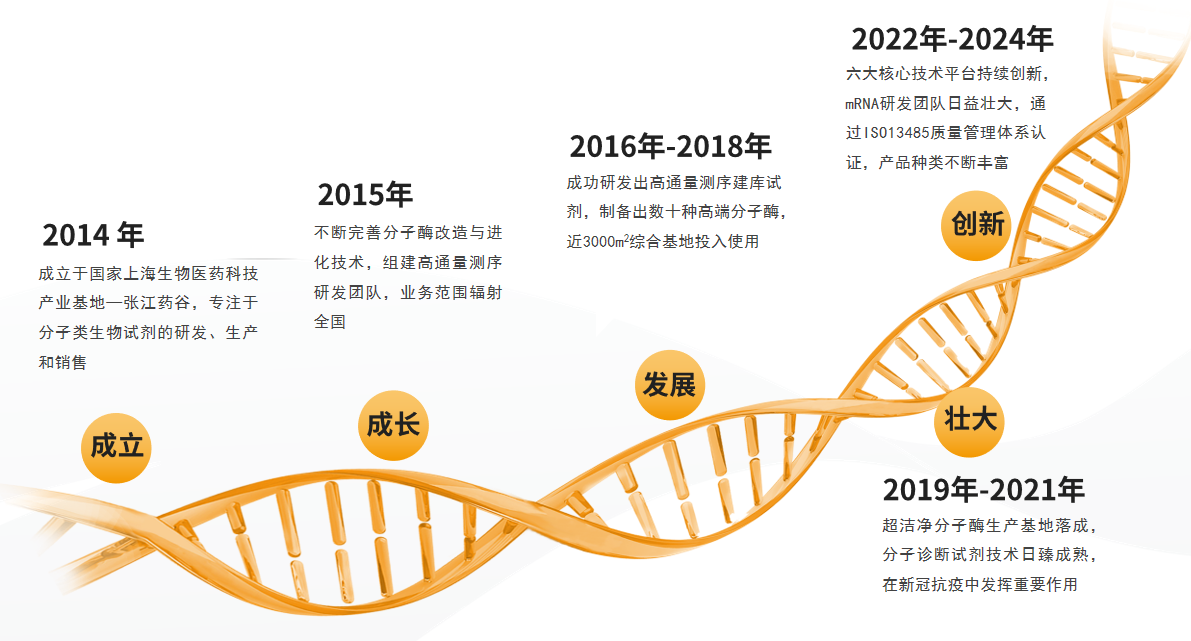
发展历程
荣誉资质
翌圣生物通过申请商标和软件著作权的方式保障核心技术和市场竞争力,不断加强公司品牌建设。截至2022年3月31日,公司已经获得授权18项(其中发明14项、实用新型1项、外观设计3项)和45项与生物试剂相关的软件著作权,拥有经国家知识产权局商标局核准的注册商标权37项以及4项境外注册商标,是国家高新技术企业和上海市专精特新企业。

创新平台
经过多年的产品研发技术经验的沉淀以及持续的研发创新,翌圣生物积极开展“产学研”合作,与拥有生物催化与酶领域国家重点实验室的湖北大学、拥有教育部工业生物领域重点研究基地的江南大学展开合作,优化生物试剂关键原料的生产和表达工艺。翌圣生物以基因工程技术、生物信息技术、细胞生物学技术、免疫学技术、生化分析技术等生命科学领域的共性生物技术为基础,建立了六大核心技术平台——双向分子酶理性设计与定向进化平台、密度发酵与超洁净纯化平台、分子诊断试剂关键原料研发平台、高通量测序建库试剂创新研发平台、高性能单克隆抗体研发平台和mRNA医药应用研发平台,目前已经自主研发出20项核心技术,打通分子酶、蛋白、抗体、核酸、细胞的技术开发路径,覆盖技术研发、产品升级、规模生产和质量控制等生物试剂研发和生产的各关键环节。




工业化生产
翌圣生物拥有按照准GMP 标准建设运营的工业化生产基地,配有吨级发酵线、工业级 AKTA 纯化线和全自动包装线。同时,公司通过了ISO 13485:2016质量管理体系认证,从原料控制、生产管理、质检管控、仓储运输等对生产线进行360度管理监督,保证产品过程的可控制性及可追溯性,竭尽全力为您提供可靠的产品。

客户服务
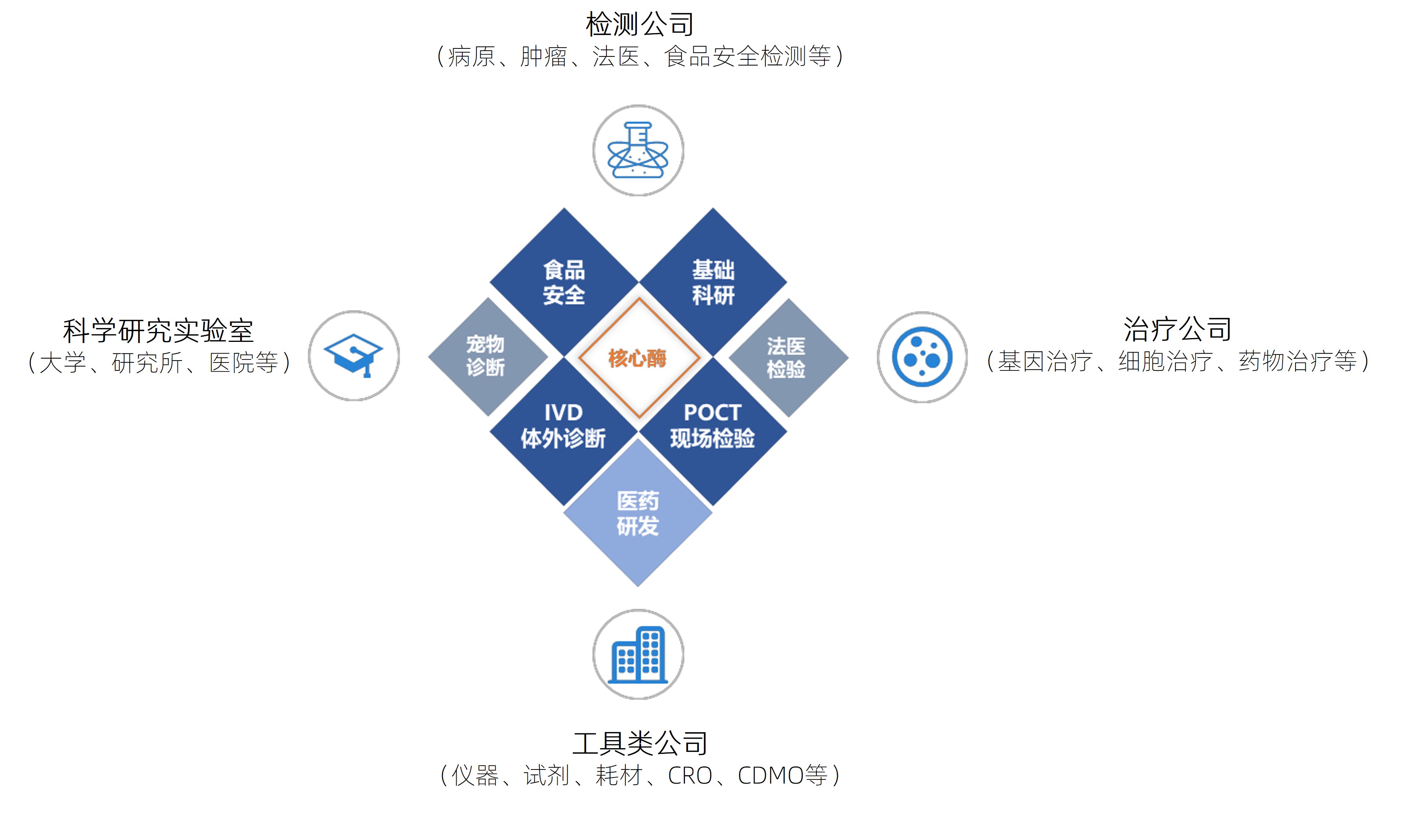
翌圣生物凭借优质稳定的产品质量、高效及时的响应能力、快速稳定的交付能力和周到完备的售后服务获得了众多科研用户和工业用户的认可,为检测公司、治疗公司、工具类公司和科学研究实验室提供应用于科学研究、体外诊断、基因测序、生物医药等的生物试剂。与中国科学院、清华大学、北京大学、复旦大学、上海交通大学、浙江大学等顶尖科研院所和华大基因、恒瑞医药、药明康德、之江生物、圣湘生物、斯微生物、金斯瑞、思路迪等工业客户建立了稳定、紧密的合作关系,公司产品被多次使用在Nature、Science、Cell等国际顶级期刊论文发表中。
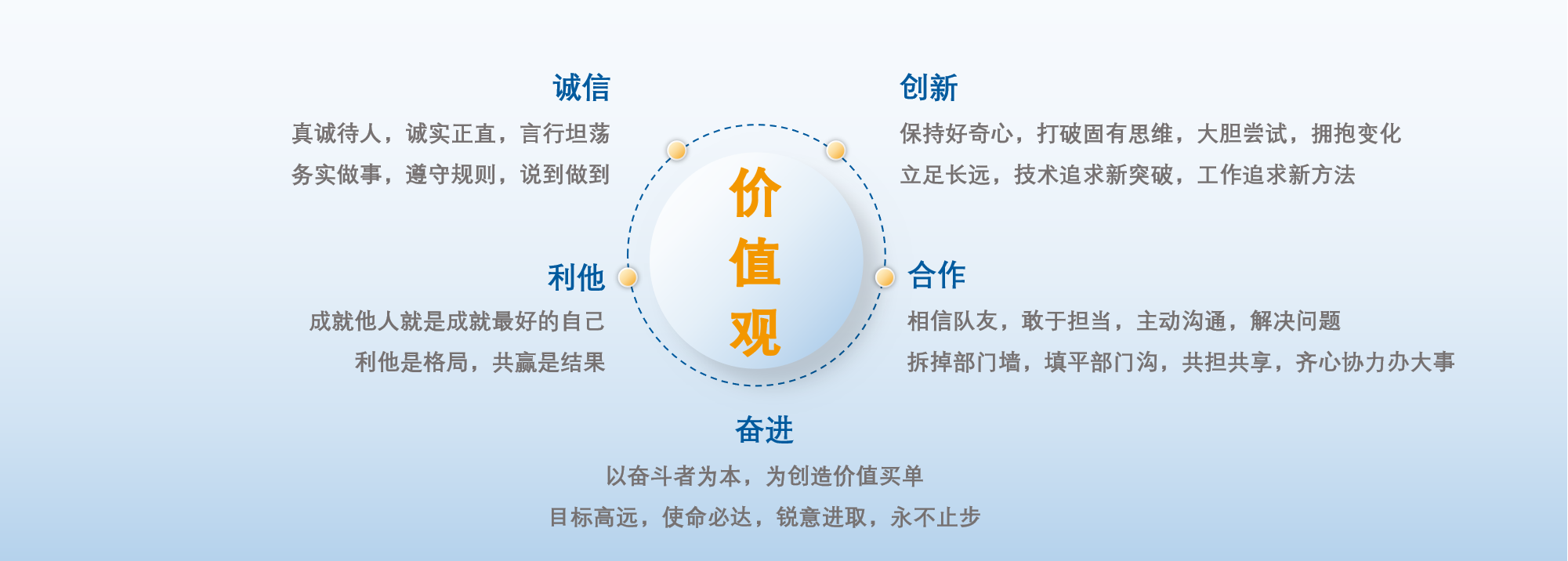
公司企业文化
帮助客户创造价值,让世界更健康更快乐
◎ 成为生命科学工具领域全球Top⑩
◎ 具备驱动产业变革的技术创新能力
◎ 拥有一支持续学习型的翌圣铁军
翌圣生物始终秉承“帮助客户创造价值,让世界更健康更快乐”的使命,专注于技术创新和产品升级,不断拓展核心技术的应用领域,为客户提供更为的产品与服务,助力我国打造自主可控的生物试剂产业链。同时,翌圣生物将进一步推进国际化战略,继续布局和拓展海外市场,为全球生物试剂产业发展贡献力量。
详细信息
产品简介
Plant Tissue Direct PCR Kit (With Dye)植物组织直接PCR试剂盒是一款可直接对不同类型植物叶片进行PCR扩增的试剂盒,适应性广、稳定性强。试剂盒采用的裂解缓冲液体系,可以快速的裂解多种植物样品并释放出基因组DNA,不需要除去蛋白、RNA或次生代谢产物等,即可将释放出的基因组DNA作为模板直接用于PCR反应。此外,样品使用量少,低至1 mm植物叶片即可进行实验。
本试剂盒中提供的2× Plant Master Mix具有很强的扩增兼容性,能直接以待测样品裂解液为模板,进行高效特异性扩增。该试剂为2倍浓缩PCR反应混合液,包含了用于PCR扩增除模板和引物外的所有组分,大大简化操作过程,降低污染几率。
该试剂盒可用于转基因植株鉴定、植物基因分型等。
组分信息
类别 | 组分编号 | 组分名称 | 10187ES05 | 10187ES50 | 10187ES70 |
Part I | 10187-A | Buffer P1 | 250 μL | 1.25 mL × 2 | 5 mL × 2 |
10187-B | Buffer P2 | 50 μL | 500 μL | 1 mL × 2 | |
Part II | 10187-C | 2 × Plant Master Mix* | 50 μL | 500 μL | 1 mL × 2 |
*2× Plant Master Mix:包含热启动Taq DNA聚合酶、dNTP混合物、MgCl2、反应缓冲液、PCR反应增强剂、优化剂以及稳定剂等,同时包含电泳Loading Buffer,PCR完成之后可直接电泳。
储存条件
1. 试剂10187-A【Buffer P1】,置于2-8℃保存。有效期1年。
2. 试剂10187-B【Buffer P2】,中和裂解产物,利于更长时间保存样本,置于2-8℃保存。有效期1年。
3. 试剂10187-C【2 × Plant Master Mix】,-25~-15℃保存,避免反复冻融。有效期1年。
使用说明
植物叶片
1、研磨裂解法:
a. 研磨仪破碎:将直径5 mm左右的叶片置于50 μL Buffer P1中,用研磨仪加钢珠(钢珠直径3mm左右,共2个)破碎叶片(45 Hz,1 min),叶片破碎后溶液呈现绿色,瞬时离心,上清液请放在4℃备用,取1 μL用于PCR扩增。
b. 枪头捣碎:推荐使用幼嫩叶片。将直径5 mm左右的叶片置于50 μL Buffer P1中,用枪头将叶片捣碎,捣碎后溶液呈现绿色,瞬时离心,上清液请放在4℃备用,取1 μL用于PCR扩增。
1、加热裂解法:推荐使用幼嫩叶片。将直径5 mm左右的叶片置于50 μL Buffer P1中,95℃加热5-10 min(确保裂解液 浸没叶片),较难裂解的叶片(老叶片)可适当延长时间(10-20 min),加热裂解后溶液呈现绿色,震荡混匀,瞬时离心,上清液请放在4℃备用,取1 μL用于PCR扩增。
1、直接法:推荐使用幼嫩叶片。使用打孔器或者刀,将直径1 mm左右的叶片直接加入到PCR反应体系中;复杂样本或者是长片段的扩增,推荐使用直径<1 mm的叶片。
PCR反应体系
组分 | 体积(μL) | 体积(μL) | 终浓度 |
2× Plant Master Mix | 10 | 25 | 1× |
Forward Primer (10 μM) | 0.5 | 1 | 0.2-0.25 μM |
Reverse Primer (10 μM) | 0.5 | 1 | 0.2-0.25 μM |
裂解产物(DNA模板) | 1 | 2 | - |
ddH2O | To 20 | To 50 | - |
表1 反应体系
【注】:各组分使用前应充分混匀。
模板加入量:小于PCR反应体系的5%,过多会严重抑制PCR反应,强烈推荐加入1 μL模板。叶片直扩优先推荐研磨仪裂解法。
引物终浓度:0.2-0.25 μM可以得到较好结果。反应性能较差时,可在0.1-0.5 μM范围内调整引物浓度。
反应体系:推荐使用20 μL或50 μL,以保证目的基因扩增的有效性和重复性。
体系配制:配制好PCR反应体系,置于涡旋仪上涡旋混匀,瞬时离心将反应液集于管底。
对照反应:建议进行PCR时,设置阳性和阴性PCR对照反应以便于排除假阳性或假阴性的干扰。
为了更稳定的保存裂解后的模板,将转移出来的上清液,按照裂解产物(DNA模板):Buffer P2 = 5:1的比例混合,混匀后-20℃保存,稳定保存随时间和样本状态不同而有所不同。如果处理后的植物叶片上清液一周内用于PCR扩增,不用加Buffer P2,上清液请保存在-20℃。
反应条件
循环步骤 | 温度 (°C) | 时间 | 循环数 |
预变性 | 94 | 5 min | 1 |
变性 | 94 | 10 sec | 35 |
退火 | 50-65 | 20 sec | |
延伸 | 72 | 1 min/kb | |
终延伸 | 72 | 5 min | 1 |
表2 反应条件 | |||
【注】:
退火温度:请参考引物的理论 Tm 值,退火温度可设置低于引物理论值 2-5℃。
延伸时间:需要根据片段的长度来确定,对于1 kb以内的DNA片段,建议延长时间为1 min。
注意事项
做叶片实验时,建议使用新鲜采取的叶片组织,若为长期冷冻组织,需-80℃保存,应尽量避免反复冻融,以免造成模板降解,影响PCR效率。叶片组织以幼嫩为宜,若为成熟的叶片,避免使用叶片主脉部位组织。
建议扩增片段长度1 kb以内,以便扩增效率佳。
取样时使用打孔器或者刀取适宜大小的样本,样本不同时,打孔器或者刀每次处理样本前需清洗干净。
对于叶片组织,建议取1-10 mm的叶片,过小会使PCR扩增产量低,过多会抑制PCR反应,采用加热裂解法、枪头捣碎、研磨仪破碎的方式处理植物叶片,处理后需震荡离心,务必取上清液试验,沉淀会严重抑制PCR反应。
为了您的安全和健康,请穿实验服并佩戴一次性手套操作。
本产品仅作科研用途!
常见问题与解决方法
常见问题 | 可能原因 | 解决方法 |
阳性对照、待测样本均无条带 | PCR反应体系或反应条件不合适。 | 使用梯度PCR摸索PCR最佳反应条件。 |
PCR试剂保存不当失去活性。 | 2× PCR Mix应保存于-20℃,使用时避免反复冻融。若使用频繁,可在4℃短时间存放。 | |
引物设计问题。 | 尝试重新设计引物进行检查。 | |
阳性对照有目的条带,待测样本无条带或条带弱 | 裂解液、中和液加入比例不当,裂解混合液影响PCR体系的pH值。 | 正常条件下,中和后的裂解混合液的pH应该在7-8左右(裂解产物和Buffer P2严格按照5:1的量进行中和)。 |
样本裂解混合液保存不当或保存时间过久,DNA基因组已经降解。 | 裂解混合液液可在4℃保存5天,尽量使用新制备的裂解液混合液进行PCR。 | |
模板加入量不适合。 | 在反应体系<5%范围内优化模板加入量。 | |
PCR循环数不足。 | 适当增加PCR的循环数,推荐35-40循环为佳。因模板复杂,一般PCR反应要比用纯化的DNA模板多5-10个循环为佳。 | |
非特异性扩增 | PCR退火温度太低,循环数、引物浓度或模板浓度太高。 | 增加PCR退火温度,降低PCR循环数、引物浓度或模板浓度。 |
PCR引物错配。 | 重新设计PCR引物。 | |
配制PCR反应体系时温度太高或配制完成后放置时间太久。 | PCR反应体系的配制在低温下进行,配制完成后尽快进行PCR扩增反应。 | |
阴性对照出现目的条带 | 操作工具或试剂污染。 | 实验所有试剂或器材均应高压灭菌。操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。 |
样本间交叉污染。 | 每个取样器只对一个样本使用;或取完一个样本后,将取样器刃口浸入2%的次氯酸钠溶液中,反复涮洗,然后用干净的纸巾擦干残液。 |














