41313ES CAR/TCR Copynumber Detection Kit CAR/TCR
该企业相似产品
企业简介
翌圣生物科技(上海)股份有限公司【Yeasen Biotechnology (Shanghai) Co., Ltd.】是一家以蛋白质改造和酶进化技术为驱动,聚焦生命科学产业链上游核心原料,从事分子、蛋白和细胞三大品类生物试剂的研发、生产与销售的高新技术企业,通过打通分子酶、蛋白、抗体、核酸、细胞的技术开发路径,成为国内少数同时覆盖三大品类生物试剂、兼备核心技术自主研发能力和规模化生产能力的高新技术企业,产品广泛应用于生命科学研究领域、诊断与检测领域和生物医药领域。
主营业务
公司凭借在蛋白质改造和酶进化领域的技术优势和深耕生物试剂行业多年积累的丰富经验,构建了品质优良、类型齐全、种类丰富的产品管线。自公司成立以来,公司研发、生产和销售的生物试剂超过3000种,涵盖分子、蛋白、细胞三大品类的生物试剂,能够满足客户多种类型生物试剂的一体化采购需求。公司核心产品覆盖qPCR系列、NGS系列、逆转录系列、核酸提取与纯化系列、PCR系列、分子克隆系列、体外转录系列、抗体、蛋白纯化系列、蛋白分析系列、重组蛋白、细胞分析系列、细胞培养系列、细胞转染系列、报告基因检测系列等多个品类的生物试剂,广泛应用于生命科学研究、诊断检测和生物医药等领域。
发展历程
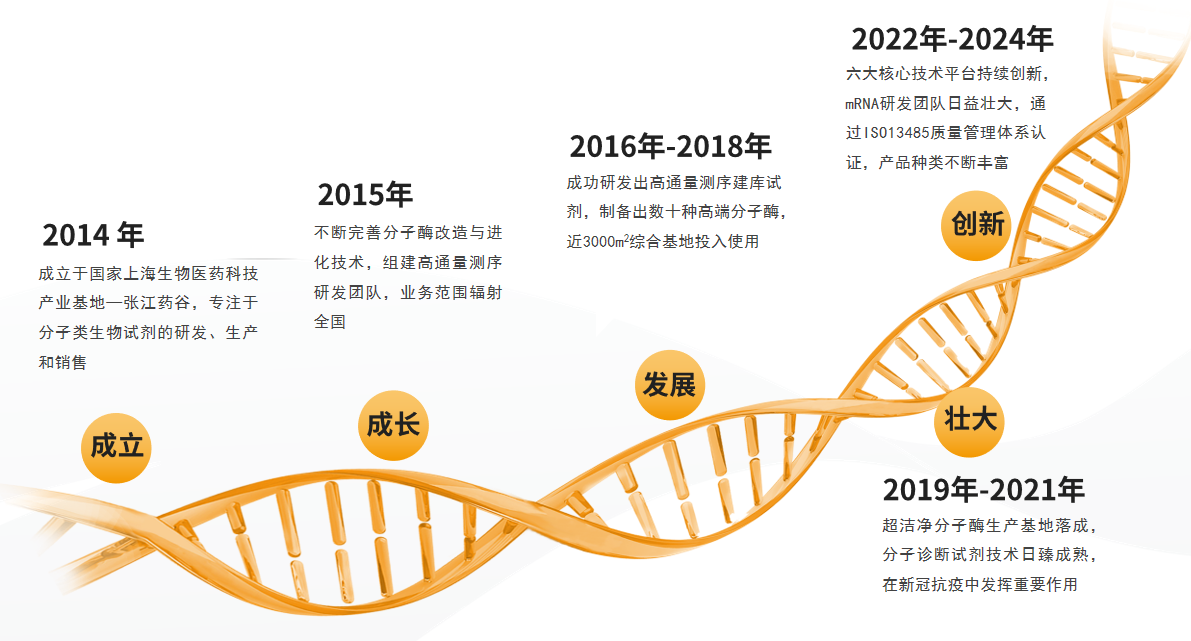
荣誉资质
翌圣生物通过申请商标和软件著作权的方式保障核心技术和市场竞争力,不断加强公司品牌建设。截至2022年3月31日,公司已经获得授权18项(其中发明14项、实用新型1项、外观设计3项)和45项与生物试剂相关的软件著作权,拥有经国家知识产权局商标局核准的注册商标权37项以及4项境外注册商标,是国家高新技术企业和上海市专精特新企业。

创新平台
经过多年的产品研发技术经验的沉淀以及持续的研发创新,翌圣生物积极开展“产学研”合作,与拥有生物催化与酶领域国家重点实验室的湖北大学、拥有教育部工业生物领域重点研究基地的江南大学展开合作,优化生物试剂关键原料的生产和表达工艺。翌圣生物以基因工程技术、生物信息技术、细胞生物学技术、免疫学技术、生化分析技术等生命科学领域的共性生物技术为基础,建立了六大核心技术平台——双向分子酶理性设计与定向进化平台、密度发酵与超洁净纯化平台、分子诊断试剂关键原料研发平台、高通量测序建库试剂创新研发平台、高性能单克隆抗体研发平台和mRNA医药应用研发平台,目前已经自主研发出20项核心技术,打通分子酶、蛋白、抗体、核酸、细胞的技术开发路径,覆盖技术研发、产品升级、规模生产和质量控制等生物试剂研发和生产的各关键环节。




工业化生产
翌圣生物拥有按照准GMP 标准建设运营的工业化生产基地,配有吨级发酵线、工业级 AKTA 纯化线和全自动包装线。同时,公司通过了ISO 13485:2016质量管理体系认证,从原料控制、生产管理、质检管控、仓储运输等对生产线进行360度管理监督,保证产品过程的可控制性及可追溯性,竭尽全力为您提供可靠的产品。

客户服务
翌圣生物凭借优质稳定的产品质量、高效及时的响应能力、快速稳定的交付能力和周到完备的售后服务获得了众多科研用户和工业用户的认可,为检测公司、治疗公司、工具类公司和科学研究实验室提供应用于科学研究、体外诊断、基因测序、生物医药等的生物试剂。与中国科学院、清华大学、北京大学、复旦大学、上海交通大学、浙江大学等顶尖科研院所和华大基因、恒瑞医药、药明康德、之江生物、圣湘生物、斯微生物、金斯瑞、思路迪等工业客户建立了稳定、紧密的合作关系,公司产品被多次使用在Nature、Science、Cell等国际顶级期刊论文发表中。
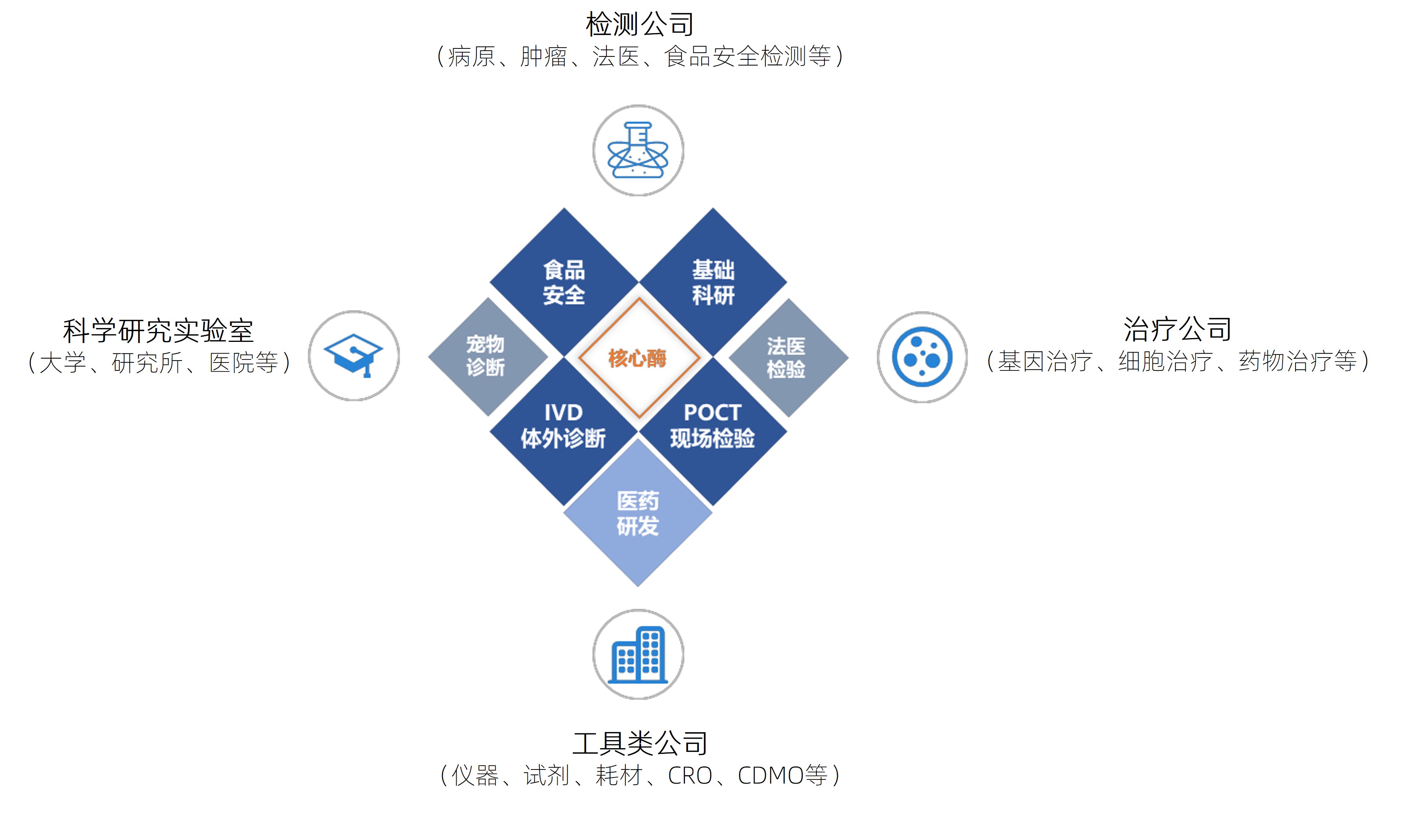
公司企业文化
帮助客户创造价值,让世界更健康更快乐
◎ 成为生命科学工具领域全球Top⑩
◎ 具备驱动产业变革的技术创新能力
◎ 拥有一支持续学习型的翌圣铁军
翌圣生物始终秉承“帮助客户创造价值,让世界更健康更快乐”的使命,专注于技术创新和产品升级,不断拓展核心技术的应用领域,为客户提供更为的产品与服务,助力我国打造自主可控的生物试剂产业链。同时,翌圣生物将进一步推进国际化战略,继续布局和拓展海外市场,为全球生物试剂产业发展贡献力量。
详细信息
产品简介
CAR/TCR基因拷贝数检测试剂盒适用于定量检测来源于HIV-1型慢病毒载体技术制备的人源细胞产品,如CAR-T或TCR-T细胞基因组中CAR或TCR基因的拷贝数。
CAR/TCR基因拷贝数检测试剂盒基于荧光探针定量PCR原理,采用多重qPCR方法分别检测转移质粒上与整合或表达功能相关的DNA序列和人体细胞中单拷贝基因(Single Copy Gene, SCG)的方法,计算得到样本中平均每个细胞的目的基因拷贝数,如CAR或TCR基因拷贝数水平。其定量限可以达到101 copies/μL水平。该试剂盒需要与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES/18462ES)配套使用。
产品信息
货号 | 41313ES50 / 41313ES60 |
规格 | 50 T / 100 T |
组分信息
组分编号 | 组分名称 | 41313ES50 | 41313ES60 |
41313-A | CAR/TCR qPCR Mix | 0.75 mL | 1.5 mL |
41313-B | CAR/TCR Primer&probe Mix | 200 μL | 400 μL |
41313-C | DNA Dilution Buffer | 2×1.8 mL | 4×1.8mL |
41313-D | CAR/TCR DNA Control (2.1×108 copies/μL) | 25 μL | 50 μL |
41313-E | IC* | 50 μL | 100 μL |
*IC:Internal control,内部对照。
运输和储存条件
1. 所有组分均干冰运输,-25~-15℃保存,有效期2年。且41313-A和41313-B均需避光保存。
2. 收到货后,请检查共5个组分是否齐全,并立即放入对应的保存温度中储存。
适用机型
包含但不限于以下仪器:
Thermo Scientific:ABI 7500,ABI Quant Studio 5;
上海宏石医疗科技:SLAN-96S。
使用说明
CAR/TCR DNA定量参考品的稀释和标准曲线的制备
CAR/TCR DNA定量参考品是同时含有CAR/TCR目的基因序列和SCG目的基因序列的质粒DNA,所以试剂盒的CAR/TCR DNA Control组分里,CAR/TCR和SCG的基因拷贝数是一样的。
用试剂盒中的DNA Dilution Buffer(DNA稀释液)将CAR/TCR DNA Control定量参考品进行梯度稀释*,稀释浓度依次为2.1×106 copies/μL、2.1×105 copies/μL、2.1×104 copies/μL、2.1×103 copies/μL、2.1×102 copies/μL。操作如下:
1)将试剂盒中CAR/TCR DNA Control和DNA Dilution Buffer置于室温融化,然后轻微振荡混匀,低速离心10 sec。
2)取6支干净的1.5 mL离心管,分别标记为Std0、Std1、Std2、Std3、Std4、Std5。
3)在标记Std0的1.5 mL管中加90 μL DNA Dilution Buffer和10 μL CAR/TCR DNA Control,即稀释为2.1×107 copies/μL,振荡混匀后短暂快速离心10 sec,该浓度可分装置于-25~-15℃短期保存(不超过6个月)**,使用时避免反复冻融。
4)在Std1、Std2、Std3、Std4、Std5管中先分别加入90 μL DNA Dilution Buffer***,再进行梯度稀释****,稀释方法如下:
稀释管 | 稀释比例 | 终浓度 | |
CAR/TCR (copies/μL) | SCG (copies/μL) | ||
Std1 | 10 μL Std0 + 90 μL DNA Dilution Buffer | 2.1×106 | 2.1×106 |
Std2 | 10 μL Std1 + 90 μL DNA Dilution Buffer | 2.1×105 | 2.1×105 |
Std3 | 10 μL Std2 + 90 μL DNA Dilution Buffer | 2.1×104 | 2.1×104 |
Std4 | 10 μL Std3 + 90 μL DNA Dilution Buffer | 2.1×103 | 2.1×103 |
Std5 | 10 μL Std4 + 90 μL DNA Dilution Buffer | 2.1×102 | 2.1×102 |
表1 标准品梯度稀释
*每个浓度做3个复孔,该试剂可测试2.1×106 copies/μL~2.1×102 copies/μL线性范围。若需要,可适当扩大或缩小线性范围。
**为减少反复冻融次数和避免污染,建议初次使用时将DNA定量参考品分装储存于-25~-15℃。
***已融化未使用的DNA Dilution Buffer可保存于2~8℃ 7天,若长时间不用,请放置于-25~-15℃。
****为确保模板混匀,每个梯度稀释时需轻微震荡混匀约1 min。
样本加标回收质控ERC的制备
根据需要设置ERC中CAR/TCR DNA标准品浓度(以制备加2.1×104 copies CAR/TCR DNA量的ERC为例),具体操作:
1) 取100 μL待测样本加入1.5 mL洁净的离心管中,再加入10 μL Std4,混匀,标记为ERC。
2) 加标回收ERC和同批待测样本一起进行样本前处理,制备加标回收ERC纯化液。
阴性抽提质控NCS的制备
根据实验设置阴性抽提质控NCS,具体操作如下:
1) 取100 μL样本基质溶液(或DNA Dilution Buffer)加入1.5 mL洁净的离心管中,标记为NCS。
2) 阴性质控NCS和同批待测样本一起进行样本前处理,制备成阴性质控NCS纯化液。
无模板对照NTC的制备
根据实验设置无模板对照NTC,具体操作如下:
1) 无模板对照NTC无需进行样本前处理,在qPCR法检测CAR/TCR DNA含量阶段开始配置即可。
2) 每管或孔中的NTC反应体系为20 μL Mix混合液(即15 μL CAR/TCR qPCR Mix + 4μL CAR/TCR Primer&Probe Mix+ 1μL IC)+ 10 μL DNA Dilution Buffer,建议配置3个重复孔的量。
反应体系
反应体系 | 体系(μL) |
CAR/TCR qPCR Mix* | 15 |
CAR/TCR Primer&probe Mix | 4 |
IC | 1 |
DNA template** | 10 |
总体积*** | 30 |
表2 标准品反应体系
*根据反应孔数计算本次所需的Mix混合液总量:Mix混合液=(反应孔数+2)×(15+4+1) μL(含有2孔的损失量)。通常,每个样本做3个重复孔。
**反应孔数=(5个浓度梯度的标准曲线+1个无模板对照NTC+1个阴性抽提质控NCS+待测样TS个数+待测样本对应加标回收ERC个数)×3。
NTC (No Template Control):DNA Dilution Buffer
NCS (Negative Control Solution):样本基质溶液或DNA Dilution Buffer进行样本前处理后,所得纯化液为NCS
TS (Test Sample):待测样本
ERC (Extraction Recovery Control):待测样本中加入如2.1×104 copies标准品DNA后进行样本前处理,所得纯化液为加标回收ERC
***加样完成密封好管子后,请低速离心10 sec将管壁的液体离心收集至管底,再震荡混匀5 sec以上,混匀反应液,再低速离心10 sec将管壁的液体离心收集至管底,如有气泡,需将气泡排尽。
下图为参考板位:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
A | NTC | 待测样本TS1 | 待测样本TS1 | 待测样本TS1 | 标准曲线Std1 | 标准曲线Std1 | 标准曲线Std1 | |||||
B | NTC | 待测样本TS2 | 待测样本TS2 | 待测样本TS2 | 标准曲线Std2 | 标准曲线Std2 | 标准曲线Std2 | |||||
C | NTC | 待测样本TS3 | 待测样本TS3 | 待测样本TS3 | 标准曲线Std3 | 标准曲线Std3 | 标准曲线Std3 | |||||
D | 标准曲线Std4 | 标准曲线Std4 | 标准曲线Std4 | |||||||||
E | NCS | 样本加标ERC1 | 样本加标ERC1 | 样本加标ERC1 | 标准曲线Std5 | 标准曲线Std5 | 标准曲线Std5 | |||||
F | NCS | 样本加标ERC2 | 样本加标ERC2 | 样本加标ERC2 | ||||||||
G | NCS | 样本加标ERC3 | 样本加标ERC3 | 样本加标ERC3 | ||||||||
H |
表3 上机参考板位
该示例是对CAR/TCR基因拷贝数的qPCR法检测操作的展示,检测样本包括:5个浓度梯度的CAR/TCR DNA标准曲线、1个无模板对照NTC、1个阴性质控NCS、3个待测样本TS、3个样本加标回收ERC。建议每个样本做3个重复孔。
扩增程序参数设置(两步法)(以ABI公司7500 qPCR仪、软件版本2.0为例)
1)创建空白新程序,选择绝对定量检测模板。
2)创建2个检测探针,第一个命名为“CAR/TCR-DNA”,选择报告荧光基团为“FAM”,猝灭荧光基团为“None”;第二个命名为“SCG,选择报告荧光基团为“VIC”,猝灭荧光基团为“None”;再创建1个检测探针,命名为“IC”,选择报告荧光基团为“CY5”,猝灭荧光基团为“None”。参比荧光为ROX”(参比荧光可根据仪器型号等情况,选择是否需要添加;若选择ROX校准,建议阈值线选择0.06)。
3)在“Assign target (s) to the selected wells”面板中,将标准曲线孔的“Task”一栏设置为“Standard”,并且在“Quantity”一栏分别赋值为“2100000”、“210000”、“21000”、“2100”、“210”(含义为每孔的DNA浓度,单位为copies/μL),并且在相应的“sample name”一栏中命名为“2100000 copies/μL”、“210000 copies/μL”、“21000 copies/μL”、“2100 copies/μL”、“210 copies/μL”;将无模板对照NTC孔的“Task”一栏设置为“NTC”;将阴性质控NCS孔、待测样本TS孔、样本加标回收ERC孔“Task”一栏设置为“Unknown”,并且在相应的“Sample Name”一栏中分别命名为“NCS”、“TS”、“ERC”,之后点击“Start Run”,开始仪器运行。
4)扩增程序设置:设置反应体积30 μL。
循环步骤 | 温度(℃) | 时间 | 循环数 |
污染消化 | 37℃ | 5 min | 1 |
预变性 | 95℃ | 5 min | 1 |
变性 | 95℃ | 15 sec | 45 |
退火/延伸(收集荧光) | 60℃ | 30 sec |
表4 扩增程序
qPCR 结果分析
1)在“Analysis”的“Amplification Plot”面板中,系统会自动给出“Threshold”,有时系统给出的“Threshold”离基线太近,导致复孔之间Ct相差甚远,可手动调节“Threshold”至合适位置,点击“Analyze”。此时可在“Multicomponent Plot”初步查看扩增曲线的形态是否正常。
2)在“Analysis”的“Standard Curve”面板中,可读取标准曲线的R²、扩增效率(Eff%)、斜率(Slope)、截距(Intercept)等。正常的标曲:R²>0.99,扩增效率在90%≤Eff%≤110%范围内,Slope在-3.6~-3.1。
3)在“Analysis”的“View well table”面板中,“Quantity”一栏可读取无模板对照NTC、阴性质控NCS、待测样本TS、样本加标回收ERC的检测值,单位为copies/μL,后续可在检测报告中进行单位换算。
4)结果分析的参数设置需依据具体的机型及使用的软件版本,一般也可由仪器自动判读。
5)根据待测样本TS和样本加标回收ERC的检测结果计算加标回收率,加标回收率要求在50%~150%之间。加标回收率计算公式:回收率(%) = {样本加标测定值(eg.copies/µL)-样本测定值(eg.copies/µL)} x洗脱体积(µL) / DNA加入量理论值(eg.copies) x 100%。
6)阴性质控NCS的Ct值应为Undetermined或Ct值≥35。
7)无模板对照NTC的检测结果应为Undetermined或Ct值≥38。
8)每个细胞中的CAR或TCR拷贝数=![]()
注意事项
1. 使用本试剂前请仔细阅读本说明书,实验应规范操作,包括样本处理、反应体系的配制及加样。
2. 每个组分在使用前都应充分震荡混匀,低速离心。
3. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
4. 本产品仅作科研用途。









