其他品牌 品牌
代理商厂商性质
北京市所在地
LONZA荧光内毒素检测系统
(重组C因子法)

配置清单:荧光读数仪、电脑及软件、重组C因子试剂盒
重组C因子内毒素检测历程:
2012年6月,FDA将重组C因子法纳入可替代方法;
2015年7月,欧洲药典将重组C因子法纳入可替代方法;
2018年9月,FDA批准了首以重组C因子检测内毒素的单抗药;
2018年12月,欧洲药典征求意见稿将重组C因子纳入欧洲药典;
2019年1月,中国药典征求意见稿将重组C因子纳入2020版中国药典;
2019年12月,欧洲药典将重组C因子纳入到新一版的欧洲药典中,预计2021年生效。
什么是细菌内毒素?
1、是革兰氏阴性菌的细胞壁的产物。细菌在生活状态时不释放出来,只有当细菌死亡自溶或粘附在其它细胞时,才表现其毒性,内毒素的主要化学成分是脂多糖中的类脂A成分。
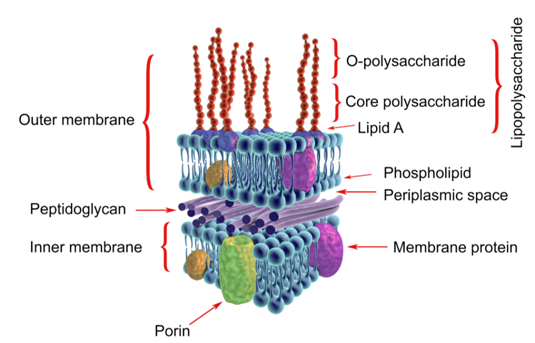
2、经消化道进入无危害,大量进入血液就会引起发热反应-“热原反应”,会激活多种炎症信号通路。因此对于所有的注射用品,植入式医疗器械均需要进行内毒素检测。
3、理化性质:内毒素不是蛋白质,因此非常耐热。只有在160℃的温度下加热2到4个小时,或用强碱、强酸或强氧化剂加温煮沸30分钟才能破坏它的生物活性。
4、生物制品(细胞制剂,药品,疫苗)无法通过这些方法去除热源 → 必须在整个生产过程中保证所有物料内毒素的含量,以满足终产品的内毒素含量符合放行标准 → 内毒素检测
荧光内毒素检测系统
Lonza内毒素检测
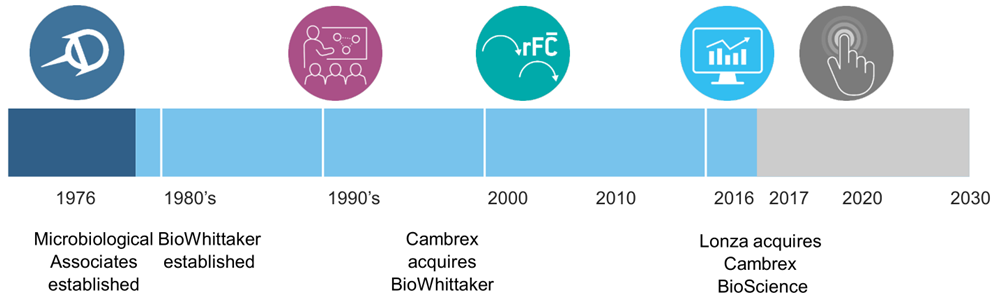
※ Lonza内毒素检测始于1976年,44年为客户提供可靠的内毒素产品和服务
※ 上市动态检测法
※ 上市重组C因子
※ Lonza提供专业的内毒素解决方案,服务对象覆盖70%的制药*企业,市场上大量的药物是通过lonza内毒素产品放行上市的
※ 市场的技术:
ü 鲎试剂+无动物源的重组C因子试剂检测内毒素
ü 全自动高通量内毒素工作站PyroTec技术
ü 符合21CFR part 11和EU GMP 附录11的内毒素检测分析软件WinKQCL
Fluorescent Endpoint Test – PyroGene ™
重组C因子法
※ PyroGene™ Recombinant Factor C Assay 是无动物源性组分的 LAL 替代方法。已经被 FDA 接受。此方法使用重组的 C 因子来代替鲎试剂级联反应的一个组分。与内毒素结合后激活并切割一个合成底物,释放出荧光分子。反应在 96 孔板中进行。在实验开始和经一小时孵育后用荧光检测仪(380Ex/440Em)进行检测。
※ 灵敏度:0.005-5EU/ml
※ 优势:
ü 通过消除假阳性反应葡聚糖,达到更高的内毒素特异性
ü 批次变化更小
ü 不使用动物制品
ü 确保供应安全
ü FDA 认可的 LAL 替代方案
※ 所需的其他材料:
ü 带孵育功能的荧光检测仪
ü WinKQCL™软件- WinKQCL 5.3.3/6.0
ü LAL 检测用水(大包装的试剂盒需要单独购买)
ü 无致热源检测管
ü LAL 检测级别多孔板
软件-WinKQCL software
• 好的内毒素检测和分析数据管理平台-24年基于用户体验持续改进(1996年version 1.0本发布)
• *符合21CFR Part 11数据完整性要求
• 全面的检测分析,数据管理,和报告需求的完整解决方案
• 支持企业在内为各个工厂提供管理和协作
• 对接第三方系统(MODA,LIMS,LIS)
• 兼容自动化工作站
目前提供两个版本软件 WinKQCL 5.3.3/6.0