探秘细胞凋亡过程
时间:2020-06-05 阅读:972
探秘细胞凋亡过程
——实用检测方法盘点
>>>背景

图1:细胞凋亡与坏死过程
细胞坏死(necrosis)是因为病理而产生的被动死亡,如物理性或化学性的损害因子及缺氧与营养不良等均导致细胞坏死。表现为细胞胀大、胞膜破裂、细胞内容物外溢、核变化较慢、DNA降解不充分和引起严重的局部炎症反应等。
细胞凋亡与细胞坏死不同,细胞凋亡(Apoptosis)一般是指机体细胞在发育过程中或在某些因素作用下通过细胞内基因及其产物的调控而发生的一种程序性细胞死亡过程, 细胞坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程。细胞凋亡途径中各事件的发生是有时序性的,即各事件按先后顺序依次发生,终导致凋亡小体的出现,细胞随后发生凋亡。细胞凋亡对胚胎发育及形态发生(morphogenesis)、组织内正常细胞群的稳定、机体的防御和免疫反应、疾病或中毒时引起的细胞损伤、老化、肿瘤的发生进展起着重要作用,并具有潜在的治疗意义。
| 区别条目 | 细胞凋亡 | 细胞死亡 |
| 起因 | 生理或是病理性刺激因子诱发 | 病理性刺激因子诱发或是剧烈损伤 |
| 作用范围 | 单个细胞 | 组织或是成群细胞 |
| 细胞形态 | 膜皱缩,体积变小 | 体积膨大,变性 |
| 细胞膜 | 保持完整直到形成凋亡小体 | 破损 |
| 细胞器 | 无明显变化 | 膨大和破损 |
| 染色质 | 凝集并在核膜周围呈现新月形帽状结构分布 | 不凝集,呈现絮状形态 |
| 凋亡小体 | 有 | 无 |
| 基因组DNA | 规律性降解,呈片段化 | 随机降解,呈现弥散型 |
| 蛋白质合成 | 有 | 无 |
| 炎症反应 | 无 | 有,释放细胞内含物 |
| 分子机制 | 与蛋白酶caspases基因家族有关 | 与蛋白激酶PIP3表达有关 |
表二:细胞凋亡的不同检测方式
| 早期检测 | PS(磷脂酰丝氨酸)在细胞外膜上的检测 | 细胞内氧化还原状态改变的检测 | 细胞色素C的定位检测 | 线粒体膜电位变化的检测 |
| 晚期检测 | TUNEL法检测 | LM-PCR Ladder (连接介导的PCR检测) | 端粒酶检测 | |
| mRNA水平检测 | Northern杂交检测 | RT-PCR跑胶检测 |
>>>探秘细胞凋亡,抓重点、找方法
细胞处于不同的凋亡阶段需要找到不同的特点,配以合适的检测工具就能准确解读细胞凋亡的密码。凋亡的细胞具有不同的生物学特征,典型的特征包括:1)细胞膜PS(磷脂酰丝氨酸)外翻;2)线粒体膜电位丧失;3)细胞核浓缩和断裂
>>>凋亡早期检测
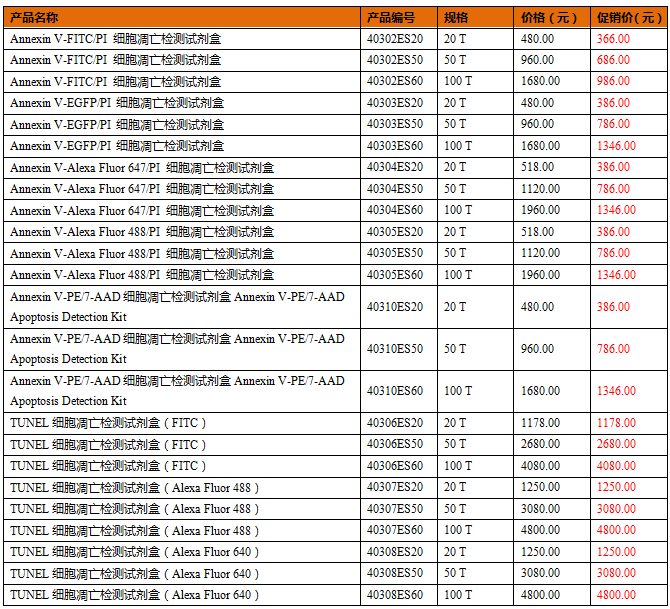
在正常细胞中,磷脂酰丝氨酸(Phosphotidylserine, PS)位于细胞膜内侧,但在早期凋亡的细胞中,PS由细胞膜的内侧翻转到细胞膜表面,暴露在细胞外环境中。Annexin-Ⅴ(膜联蛋白-V)是一种分子量为35-36 kDa的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合,通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。将 Annexin-V 与 PI 匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
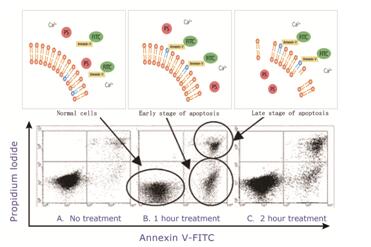
图2:Annexin-V 检测早期凋亡原理示意图
>>>线粒体膜电位变化的检测
线粒体膜电位(△Ψm )的丢失导致线粒体膜中线粒体通透性转换孔的开放,细胞色素C(Cytochrome C)被释放到细胞浆中,致使Caspase被激活从而诱导细胞凋亡。JC-1是一种广泛用于检测线粒体膜电位(△Ψm )的理想荧光探针,表现出电势依赖性的积聚在线粒体内。正常线粒体内,JC-1聚集在线粒体基质中形成聚合物,聚合物发出强烈的红色荧光;而在凋亡细胞中,线粒体跨膜电位去极化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式。因此颜色的变化将直接反映出线粒体膜电位的变化。

图3:JC-1检测荧光与流式结果示意图(图片源自科学网)
>>>凋亡晚期检测
细胞凋亡晚期,染色体DNA双链断裂或单链断裂而产生大量的粘性3’-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将荧光素/酶标记的dUTP结合到DNA的3’--OH末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal -deoxynucleotidyl transferase mediated nick end labeling,TUNEL)

图4:TUNEL法检测原理示意图
>>>客户使用数据展示
Annexin-V检测

(a-2, b-2) 100 μg/ml AuNCs@L-GSH 处理24h,(a-3, b-3) 100 μg/ml AuNCs@D-GSH 处理24h,(a-1, b-1) 无处理。
检测试剂:Cat No. 40302 Annexin-V -FITC/PI检测流式分析早期凋亡
JC-1检测
上象限中显示去极化细胞的百分比;柱状图代表正常细胞,去极化细胞和坏死细胞的平均比例
检测试剂:Cat No. 40705 JC-1检测线粒体膜电位改变.
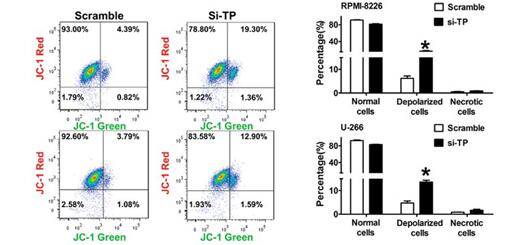
Tunel检测
小鼠前脂肪细胞3T3-L凋亡检测。行代表阴性对照,第二行代表阳性对照
检测试剂:Cat No. 40306 TUNEL Apoptosis Detection Kit (FITC)
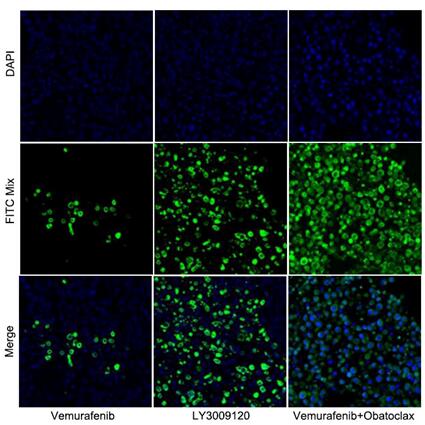
石蜡包埋的肿瘤组织(取自裸鼠)
检测试剂:Cat No. 40307 TUNEL Apoptosis Detection Kit (Alexa Fluor 488)
>>>已使用客户发表文章引用
Annexin V
[1]. Zhang C, Li C, Liu Y, et al. Gold Nanoclusters‐Based Nanoprobes for Simultaneous Fluorescence Imaging and Targeted Photodynamic Therapy with Superior Penetration and Retention Behavior in Tumors[J]. Advanced Functional Materials, 2015, 25(8): 1314-1325.IF =13.325
[2] Zhang L, Wan SS, et al. An Adenosine Triphosphate-Responsive Autocatalytic Fenton Nanoparticle for Tumor Ablation with Self-Supplied H2O2 and Acceleration of Fe(III)/Fe(II) Conversion. Nano Lett. 2018 Nov 7.IF =12.08
[3]. Zhang, C., et al., Insights into the distinguishing stress-induced cytotoxicity of chiral gold nanoclusters and the relationship with GSTP1[J]. Theranostics, 2015. 5(2): p. 134-49.IF =8.537
[4]. Hou, W., et al., pH-Sensitive self-assembling nanoparticles for tumor near-infrared fluorescence imaging and chemo-photodynamic combination therapy[J]. Nanoscale, 2016. 8(1): p. 104-16.IF =7.233
[5].Liu, H., et al., Targeting heat-shock protein 90 with ganetespib for molecularly targeted therapy of gastric cancer[J]. Cell Death Dis, 2015. 6: p. e1595.IF =5.638
[6].Wu, Z., et al., LncRNA-N1LR Enhances Neuroprotection Against Ischemic Stroke Probably by Inhibiting p53 Phosphorylation[J]. Mol Neurobiol, 2016.IF =5.076
[7]. Zhang C, Wang K, Li C, et al. Stress-induced cytotoxicity of chiral Ag nanoclusters[J]. Journal of Materials Chemistry B, 2014, 2(40): 6931-6938.IF =4.776
[8]. Liu X, Liu B, Gao S, et al. Glyco-decorated tobacco mosaic virus as a vector for cisplatin delivery[J]. Journal of Materials Chemistry B, 2017, 5(11): 2078-2085.IF =4.776
[9].Ni, C., et al., A novel mutation in TRPV3 gene causes atypical familial Olmsted syndrome[J]. Sci Rep, 2016. 6: p. 21815.IF =4.122
[10].Aipire, A., et al., Glycyrrhiza uralensis water extract enhances dendritic cell maturation and antitumor efficacy of HPV dendritic cell-based vaccine[J]. Sci Rep, 2017. 7: p. 43796.IF =4.122
[11].Cui, D., et al., Regression of Gastric Cancer by Systemic Injection of RNA Nanoparticles Carrying both Ligand and siRNA[J]. Sci Rep, 2015. 5: p. 10726.IF =4.122
[12]. Yu, H., et al., Decreased proliferative, migrative and neuro-differentiative potential of postnatal rat enteric neural crest-derived cells during culture in vitro[J]. Exp Cell Res, 2016. 343(2): p. 218-22.IF =3.309
[13]. Li, J., et al., Phenylethanoid Glycosides from Cistanche tubulosa Inhibits the Growth of B16-F10 Cells both in Vitro and in Vivo by Induction of Apoptosis via Mitochondria-dependent Pathway[J]. J Cancer, 2016. 7(13): p. 1877-1887.IF =3.249
[14].Yang, Y., et al., Human CIK Cells Loaded with Au Nanorods as a Theranostic Platform for Targeted Photoacoustic Imaging and Enhanced Immunotherapy and Photothermal Therapy[J]. Nanoscale Res Lett, 2016. 11(1): p. 285.IF =3.125
JC-1 or JC-10
[1]. Ding M, Ning J, Feng N, et al. Dynamin‐related protein 1‐mediated mitochondrial fission contributes to post‐traumatic cardiac dysfunction in rats and the protective effect of melatonin[J]. Journal of Pineal Research, 2017.IF =11.613
[2]. Bu S, Wang Q, Zhang Q, et al. Human endometrial mesenchymal stem cells exhibit intrinsic anti-tumor properties on human epithelial ovarian cancer cells[J]. Scientific reports, 2016, 6: 37019.IF =4.122
[3]. Wu W B, Menon R, Xu Y Y, et al. Downregulation of peroxiredoxin-3 by hydrophobic bile acid induces mitochondrial dysfunction and cellular senescence in human trophoblasts[J]. Scientific reports, 2016, 6.IF =4.122
[4]. Liu Q, Tao B, Liu G, et al. Thromboxane A2 receptor inhibition suppresses multiple myeloma cell proliferation by inducing p38/c-Jun N-terminal kinase (JNK) mitogen-activated protein kinase (MAPK)-mediated G2/M progression delay and cell apoptosis[J]. Journal of Biological Chemistry, 2016, 291(9): 4779-4792.IF =4.011
[5]. Pan Z, Niu Y, Liang Y, et al. β-Ecdysterone protects SH-SY5Y cells against 6-hydroxydopamine-induced apoptosis via mitochondria-dependent mechanism: Involvement of p38MAPK–p53 signaling pathway[J]. Neurotoxicity research, 2016, 30(3): 453-466.IF =3.186
[6]. Hu T A, Li P, Luo Z, et al. Chloroquine inhibits hepatocellular carcinoma cell growth in vitro and in vivo[J]. Oncology reports, 2016, 35(1): 43-49.IF =2.976
[7].Chen P, Hu T, Liang Y, et al. Synergistic inhibition of autophagy and neddylation pathways as a novel therapeutic approach for targeting liver cancer[J]. Oncotarget, 2015, 6(11): 9002.IF =2.656
TUNEL
[1]. Zhang C, Li C, Liu Y, et al. Gold Nanoclusters‐Based Nanoprobes for Simultaneous Fluorescence Imaging and Targeted Photodynamic Therapy with Superior Penetration and Retention Behavior in Tumors[J]. Advanced Functional Materials, 2015, 25(8): 1314-1325.IF =13.325
[2].Liu Q, Qian Y, Li P, et al. 131 I-Labeled Copper Sulfide-Loaded Microspheres to Treat Hepatic Tumors via Hepatic Artery Embolization[J]. Theranostics, 2018, 8(3):785-799.IF=8.537
[3]. Zhang C, Wang K, Li C, et al. Stress-induced cytotoxicity of chiral Ag nanoclusters[J]. Journal of Materials Chemistry B, 2014, 2(40): 6931-6938.IF =4.776
[4]. Shi, G., et al., Sox9 facilitates proliferation, differentiation and lipogenesis in primary cultured human sebocytes. J Dermatol Sci, 2017. 85(1): p. 44-50.IF =3.675
[5]. Jiang, Y., et al., Phosphatidic Acid Improves Reprogramming to Pluripotency by Reducing Apoptosis. Stem Cells Dev, 2016. 25(1): p. 43-54.IF =3.315
>>>附上小编一些检测实验TIP
AnnexinV/PI检测
Q:Annexin V/ PI 试剂盒能否检测除人以外其他动物细胞凋亡情况?
A:可以。因为Annexin V 是与磷脂酰丝氨酸(PS)的结合,而PS不存在种属间差异。
Q:使用Annexin V/ PI 试剂盒进行凋亡检测,用含EDTA 的胰酶消化细胞对结果有影响吗?
A:会。因为Annexin V 是Ca2+ 依赖的蛋白,EDTA会 螯合Ca2+从而影响Annexin V与PS 的结合,进而影响实验结果。
Q:如果细胞自带GFP蛋白,请问哪种凋亡检测试剂盒适用该细胞的凋亡检测?
A:选用PE标记或者APC标记的Annexin V凋亡检测试剂。
Q:对于来自血液的细胞样品,为什么去除血液中的血小板?
A:因为血小板中含有PS,其能与Annexin V结合进而干扰实验结果。
Q:Annexin -V 在实验操作上应注意哪些事项?
A:由于Annexin -V染料上带有荧光基团,在实验操作上应尽量避光操作和孵育;为保证实验结果的正确性应在染色后1h内上机检测。
TUNEL检测
Q:组织切片厚度多少比较合适?
A:组织切片过厚,会使得固定效果不理想,*控制在10μm以内。
Q:除了Paraformaldehyde固定,可不可以使用甲醇固定?
A:使用乙醇或甲醇固定会导致标记的效率较低。酸性固定液,也容易导致假阳性的出现。建议采用新鲜配置的4%中性Paraformaldehyde固定液。
Q:如何避免出现非特异性荧光标记?
A:(1)对于本身核酶或聚合酶活性水平较高的组织/细胞,例如平滑肌细胞,建议取细胞或组织后立即固定并且要充分固定,以阻止这些酶导致假阳性。
(2)在进行末端标记的时候,保证细胞或组织表面保持湿润,检测反应液能很好地覆盖样品。
Q:Tunel检测在实验操作上有哪些注意事项?
A:荧光基团长期暴露在普通光照下,会发生严重淬灭,因此在实验操作上应尽量避光操作和孵育。
荧光补偿的调节
Q:光补偿调节的原则?
A: 1)用于调节补偿的样本必须单染。
2)用来调节补偿的荧光素必须与实验用的荧光素一样(例如不能用FITC调节EGFP的补偿)。
2)横平竖直:理论上X-Mean或者Y-Mean要相等(如图所示),但在实际操作中,只需要保证单染的细胞不跨区存在。
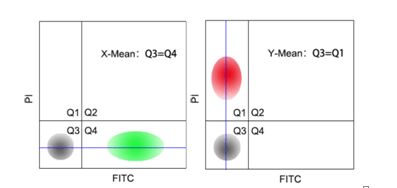
Q:如何进行光补偿的调节?
A:进行荧光补偿的调节,需要设置几组对照实验。以AnnxinV-FITC/PI双染试剂盒为例;
1)空白对照组:不进行任何标记的细胞,用于电压的调节,调整前向散射和侧向散射,得到清晰划分的细胞群体。
2)凋亡诱导的单染组:阳性对照的细胞群体需要超过分析的细胞群体的10%,用于调节补偿。
3)双染实验组:利用空白对照组和单染组调节好的参数进行实验数据的获得。
>>>相关产品