【前沿热点】石榴的肠道菌群代谢产物可提高免疫系统抗癌能力
时间:2023-03-22 阅读:273
实验结果
UA以T细胞依赖性的方式抑制肠肿瘤生长
为了研究UA依赖性自噬是否模仿了Stat3△IEC小鼠的效果,并以T细胞依赖性的方式阻止了肠道肿瘤的发展,研究者们采用了氧化偶氮甲烷 (AOM)诱导的肿瘤发生模型。FVB小鼠每周注射一次致癌物AOM,持续6周,并以含UA的饲料(2.28 g/kg)或对照饲料喂养18周(图1A)。口服UA可显著降低肿瘤发生率和肿瘤大小(图1B-1D)。随之而来的是CD3+ T细胞浸润到结肠黏膜的增多(图1E和1F)。结合肿瘤类器官APTK 类器官 (characterized by loss of Apc, Trp53, and Tgfbr2 as well as expression of oncogenic KrasG12D)系统实验 ,证实了UA诱导的肿瘤抑制依赖于T细胞。
UA以T细胞依赖性的方式抑制肠肿瘤生长
为了研究UA依赖性自噬是否模仿了Stat3△IEC小鼠的效果,并以T细胞依赖性的方式阻止了肠道肿瘤的发展,研究者们采用了氧化偶氮甲烷 (AOM)诱导的肿瘤发生模型。FVB小鼠每周注射一次致癌物AOM,持续6周,并以含UA的饲料(2.28 g/kg)或对照饲料喂养18周(图1A)。口服UA可显著降低肿瘤发生率和肿瘤大小(图1B-1D)。随之而来的是CD3+ T细胞浸润到结肠黏膜的增多(图1E和1F)。结合肿瘤类器官APTK 类器官 (characterized by loss of Apc, Trp53, and Tgfbr2 as well as expression of oncogenic KrasG12D)系统实验 ,证实了UA诱导的肿瘤抑制依赖于T细胞。
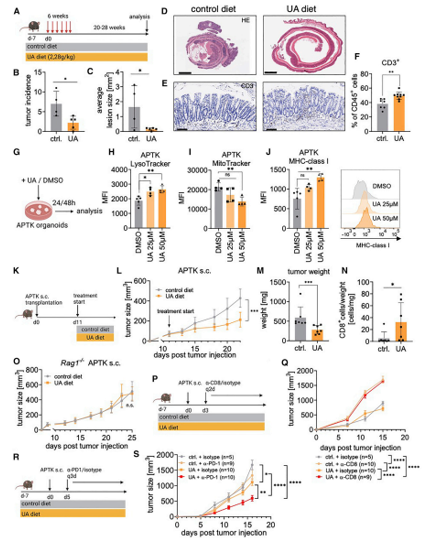
图1
UA促进TSCM分化
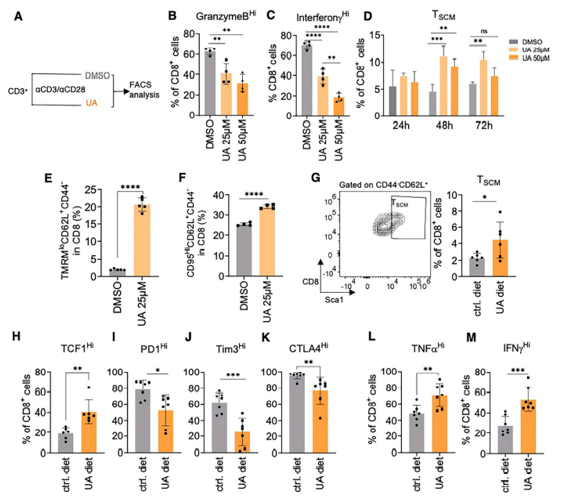
线粒体重塑与T细胞命运的改变有关。考虑到UA效应对CD8+ T细胞的依赖性,研究者们想了解UA是否也可能直接影响T细胞的命运。从FVB小鼠中纯化的T细胞被αCD3/αCD28珠刺激,诱导T细胞分化为效应T细胞亚群,无论UA存在与否,持续72小时。UA给药阻断了向效应T细胞的分化(图2B和2C),并导致幼稚CD44loCD62Lhi T细胞显著增加。此外,还观察到中枢记忆细胞(TCM)的减少,而效应记忆细胞(TEM)的频率保持不变。在CD4+细胞中,只观察到较晚时间点的变化,其特征是CD4+细胞的幼稚样减少,但TEM细胞的频率增强。
线粒体重塑与T细胞命运的改变有关。考虑到UA效应对CD8+ T细胞的依赖性,研究者们想了解UA是否也可能直接影响T细胞的命运。从FVB小鼠中纯化的T细胞被αCD3/αCD28珠刺激,诱导T细胞分化为效应T细胞亚群,无论UA存在与否,持续72小时。UA给药阻断了向效应T细胞的分化(图2B和2C),并导致幼稚CD44loCD62Lhi T细胞显著增加。此外,还观察到中枢记忆细胞(TCM)的减少,而效应记忆细胞(TEM)的频率保持不变。在CD4+细胞中,只观察到较晚时间点的变化,其特征是CD4+细胞的幼稚样减少,但TEM细胞的频率增强。
UA通过过继T细胞转移改善肿瘤治疗
研究者们从OT-1供体小鼠(图3A)中培养T细胞48小时(UA或对照),然后过继转移到免疫缺陷Rag1-/-小鼠。移植后7天,在接受了UA处理的T细胞的小鼠中,移植的CD8+ T细胞的数量更高(图3B),支持增加的扩张潜力。此外,当UA条件下的OT-1 T细胞移植到具有可触及的过表达卵白蛋白APTK (APTK- ova)肿瘤的小鼠(图3C),这导致了与对照OT-I T细胞相比更强的肿瘤抑制(图3D和3E)。对肿瘤的分析显示,在UA-T细胞转移后,肿瘤中CD44表达较低,而TCF1HiCD8+肿瘤浸润T细胞数量较高(图3F和3G)。这在肿瘤中符合UA诱导的记忆表型的维持。CD62L表达保持不变(图3H)。此外,与改善的记忆反应一致,接受UA预处理的T细胞的动物在TME中包含更少的Tim3HiPD1Hi最终耗尽的CD8+ T细胞(图3I)。因此,UA在过继细胞转移过程中增强了免疫介导的抗肿瘤记忆。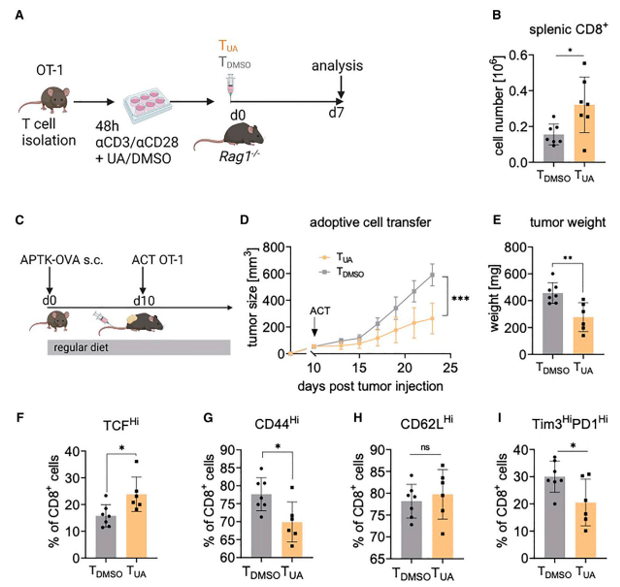
UA诱导T细胞的Pink1依赖性自噬
研究者们进一步证实,在给CD8+ T细胞服用UA后6小时内,线粒体膜电位降低(图4A和4B)。这伴随着增强的溶酶体形成(图4C), 24小时后,线粒体含量以剂量依赖性的方式丢失(图4D)。后者可以在所有分析的T细胞亚群中检测到,因此提示有丝分裂的诱导。图4的其他数据也有力地支持了UA诱导的依赖于Pink1的自噬触发TSCM的形成以增强抗肿瘤免疫的观点。
研究者们进一步证实,在给CD8+ T细胞服用UA后6小时内,线粒体膜电位降低(图4A和4B)。这伴随着增强的溶酶体形成(图4C), 24小时后,线粒体含量以剂量依赖性的方式丢失(图4D)。后者可以在所有分析的T细胞亚群中检测到,因此提示有丝分裂的诱导。图4的其他数据也有力地支持了UA诱导的依赖于Pink1的自噬触发TSCM的形成以增强抗肿瘤免疫的观点。
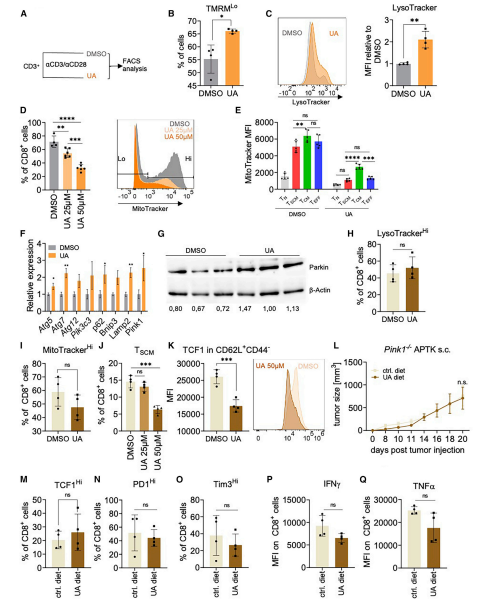
图4
UA通过Pgam5胞质释放驱动Wnt信号诱导TSCM
研究者们共鉴定出1178个差异表达基因,其中765个表达上调,413个表达下调(图5A)。UA治疗降低了免疫检查点和效应分子编码基因的表达,而增强了Cd27、Ccr7和粘附基因的表达(图5B),这是干细胞样CD8+ T细胞的一个特征。另外,研究了观察到的TCF1上调是否是Wnt信号增强的结果。根据这一概念,观察到几个Wnt靶基因的转录增加(扩展数据图4B)。此外,UA在6小时后已经导致β-连环蛋白磷酸化显著下降(图5),表明Wnt信号的激活早于转录因子的改变。图其他结果表明UA通过Wnt依赖的PGC-1a上调来驱动TSCM的形成,这是由Pgam5在自噬反应中的囊内释放所促进的。
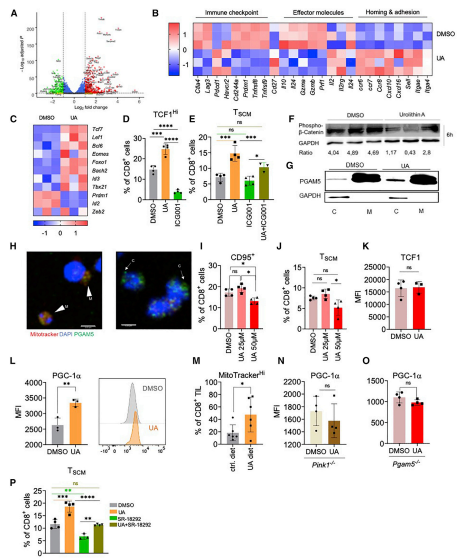
图5
UA促进人TSCM细胞,帮助产生有效的CAR - TSCM
最后,研究者们希望确定UA是否会导致人类CD8+ T细胞中TSCM细胞的扩增。从健康献血者的外周血单个核细胞(PBMCs)中分离出人CD3+ T细胞,并在UA存在的情况下体外用αCD3/αCD28珠刺激它们。事实上,在5 / 5个人供体中,UA增加了基于CD45RA+CCR7HiCD62L+CD95+CD8+表达的人类TSCM细胞的频率(图6B;图S5A和S5B)。与小鼠T细胞一样,UA处理48小时后,人CD8+ T细胞显示出线粒体膜电位下降(图6C),细胞内染色证实TCF1表达增加(图6D),证实UA诱导小鼠和人T细胞的记忆干细胞特征。为了确定UA引发的自噬是否也构成了诱导CAR-TSCM的可行策略,在存在或不存在UA的情况下,激活的T细胞通过慢病毒载体(VSV-LV)转导CD19-CAR基因。转导后3天,测定CAR -表达TSCM的数量(图6E)。UA不影响基因传递到CD8+细胞;然而,尽管在UA暴露后,CAR-表达的TSCM细胞显著增加,约占CD8+细胞的60%(图6F),但这对CD19 CAR- T细胞介导的NALM-6白血病细胞杀伤没有负面影响(图6G)。即使将UA应用于先前冷冻的癌胚抗原特异性CAR - T细胞(CEA;图6H),这种强烈增强的CAR - TSCM形成(图6I)与表达CEA的人类CRC类器官的杀伤效果相当(图6J)。因此,UA显著增强CAR-TSCM细胞的增殖。在CAR T 细胞杀伤实验中,采用了Molecular Devices 公司的SpectraMax iD3酶标仪的发光模式进行了数据读取。
最后,研究者们希望确定UA是否会导致人类CD8+ T细胞中TSCM细胞的扩增。从健康献血者的外周血单个核细胞(PBMCs)中分离出人CD3+ T细胞,并在UA存在的情况下体外用αCD3/αCD28珠刺激它们。事实上,在5 / 5个人供体中,UA增加了基于CD45RA+CCR7HiCD62L+CD95+CD8+表达的人类TSCM细胞的频率(图6B;图S5A和S5B)。与小鼠T细胞一样,UA处理48小时后,人CD8+ T细胞显示出线粒体膜电位下降(图6C),细胞内染色证实TCF1表达增加(图6D),证实UA诱导小鼠和人T细胞的记忆干细胞特征。为了确定UA引发的自噬是否也构成了诱导CAR-TSCM的可行策略,在存在或不存在UA的情况下,激活的T细胞通过慢病毒载体(VSV-LV)转导CD19-CAR基因。转导后3天,测定CAR -表达TSCM的数量(图6E)。UA不影响基因传递到CD8+细胞;然而,尽管在UA暴露后,CAR-表达的TSCM细胞显著增加,约占CD8+细胞的60%(图6F),但这对CD19 CAR- T细胞介导的NALM-6白血病细胞杀伤没有负面影响(图6G)。即使将UA应用于先前冷冻的癌胚抗原特异性CAR - T细胞(CEA;图6H),这种强烈增强的CAR - TSCM形成(图6I)与表达CEA的人类CRC类器官的杀伤效果相当(图6J)。因此,UA显著增强CAR-TSCM细胞的增殖。在CAR T 细胞杀伤实验中,采用了Molecular Devices 公司的SpectraMax iD3酶标仪的发光模式进行了数据读取。
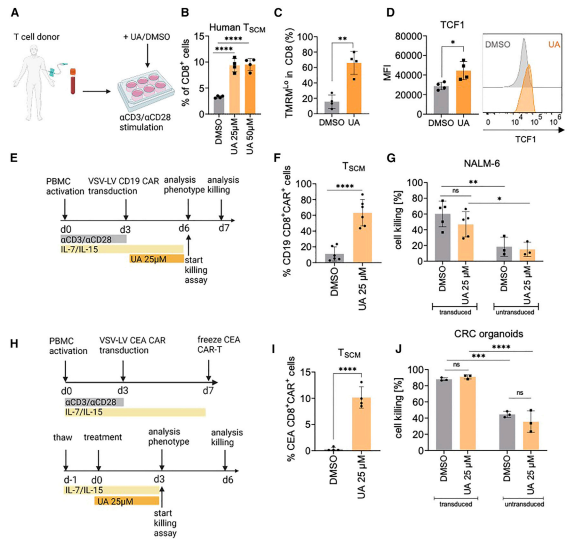
图6
总结
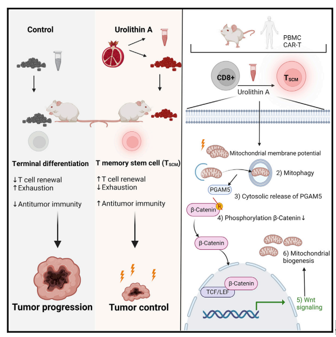
T记忆干细胞(TSCM)表现出增强的自我更新能力和延长的生存能力,从而防止T细胞衰竭,促进有效的抗肿瘤T细胞反应。TSCM细胞可以被尿石素A (UA)扩增。 (UA)是由肠道微生物群系从富含鞣花丹宁的食物中产生的,已被证明可以改善线粒体健康状态。口服UA给荷瘤小鼠提供了强大的抗肿瘤CD8+ T细胞免疫,而体外UA预处理的T细胞在过继细胞转移后显示出更好的抗肿瘤功能。UA诱导的TSCM的形成依赖于Pink1介导的自噬触发线粒体磷酸酶Pgam5的胞质释放。胞质Pgam5去磷酸化β-catenin,驱动Wnt信号通路和代偿性线粒体生物发生。总的来说,研究者们揭示了一个连接自噬和TSCM形成的关键信号通路,并认为耐受性良好的代谢化合物UA是改善免疫治疗的一个有吸引力的选择。
T记忆干细胞(TSCM)表现出增强的自我更新能力和延长的生存能力,从而防止T细胞衰竭,促进有效的抗肿瘤T细胞反应。TSCM细胞可以被尿石素A (UA)扩增。 (UA)是由肠道微生物群系从富含鞣花丹宁的食物中产生的,已被证明可以改善线粒体健康状态。口服UA给荷瘤小鼠提供了强大的抗肿瘤CD8+ T细胞免疫,而体外UA预处理的T细胞在过继细胞转移后显示出更好的抗肿瘤功能。UA诱导的TSCM的形成依赖于Pink1介导的自噬触发线粒体磷酸酶Pgam5的胞质释放。胞质Pgam5去磷酸化β-catenin,驱动Wnt信号通路和代偿性线粒体生物发生。总的来说,研究者们揭示了一个连接自噬和TSCM形成的关键信号通路,并认为耐受性良好的代谢化合物UA是改善免疫治疗的一个有吸引力的选择。
