WSAO-OCT在人视锥细胞镶嵌体活体成像中的应用
时间:2022-06-01 阅读:809
无波前传感器自适应光学相干断层成像(WSAO-OCT)是一种用于体内高分辨率、深度分辨成像的新型成像技术,它改善了基于传感器的自适应光学设计中的一些问题。这项技术用深度分辨、图像驱动的优化算法取代了Hartmann-Shack波前传感器,其度量基于实时获取的OCT体积。本研究中,Kevin S. K. Wong等使用必需的定制超高速GPU处理平台和快速模式优化算法,实现了人视网膜的实时、体内、无波前传感器AO校正成像。WSAO-OCT尤其有助于开发临床高分辨率视网膜成像系统,基于其能够允许使用紧凑、低成本且稳健的透镜自适应光学设计。本文将WSAO-OCT系统用于人感光细胞镶嵌体体内成像,通过对视网膜上的几个偏心点成像,对该系统性能进行了验证,并证明了WSAO补偿能够改善对光感受器的可见度。文章以“In vivo imaging of human photoreceptor mosaic with wavefrontsensorless adaptive optics optical coherence tomography”为题发表于Biomed Opt Express.。
背景
在大数值孔径(NA)(大成像瞳孔)的高分辨率活体视网膜成像中,自适应光学(AO)至关重要。AO已与各种眼部成像技术相结合,通过校正光学像差来获得衍射极限分辨率。眼底摄影术和扫描激光眼底镜术(SLO)是两个AO生物医学应用的实例,通过AO能够对锥状和杆状光感受器镶嵌体进行可靠成像。光学相干断层扫描(OCT)与AO相结合也可实现高分辨率体积成像。传统的成像系统在不应用OA的情况下尽管也能对健康参与者的锥形感光器成像,但在中央凹附近的视网膜偏心处(<2°) 或是有眼部缺陷及较大像差的病人中,并不能可靠成像。
大NA的视网膜成像固有地放大了参与者眼睛像差的影响,从而影响分辨率。AO的目标是用自适应元件,如变形镜(DM),补偿这些光学像差,而变形镜通常由连接在反馈AO校正回路中的波前传感器(WFS)控制。带有波前传感器的闭环AO配置已被用于大多数AO检眼镜中。但波前传感器也存在一些问题,如非共路像差、波前光斑中心化和波前畸变等,如果忽视这些可能会影响AO校正性能。此外对背面反射的敏感性也是WFS的另一个限制因素。大多数AO系统使用球面镜减轻背面反射,但在离轴配置中球面镜会导致较大的系统像差,通常可使用长焦距镜减小像差,球面镜望远镜的非平面折叠是减少系统像差的一种方法,并且用这种AO-SLO系统已经成功成像并分辨出了人杆状和中央凹锥状感受器。有研究提出一种基于透镜的AO-SLO设计,使用偏振技术减少WFS中的后向反射,以替代球面镜系统,获得的性能与非平面折叠望远镜类似。
已知波前无传感器自适应光学(WSAO)是一种很稳健策略,可规避传统基于传感器的自适应光学系统的局限性。无传感器自适应光学技术已应用于人体内SLO成像系统,有研究将其与相应的波前传感器AO-SLO进行了定量比较,尽管无传感器方法的收敛时间相对较长,但基于图像的该系统产生的图像质量至少能够与波前传感器SLO获得的图像质量相当。
作者之前展示过一种用于小动物成像的WSAO-OCT系统,在色素沉着和白化小鼠身上进行了展示和评估。使用DM的模态控制开发了WSAO-OCT技术,使收敛速度更快。系统的A-scan采集速率为100kHz,整个优化过程需要约60s。虽然这一采集和优化速度足以对麻醉小鼠进行成像,但由于眼和头的不自主运动、眨眼和参与者疲劳,其速度还不足以可靠地用于人活体视网膜成像。
而本文描述了一种用于人体视网膜感光层活体成像的WSAO-OCT系统。介绍了WSAO-OCT光学系统和实时数据采集处理平台的设计,描述了为人类视网膜成像量身定制的WSAO-OCT优化过程,通过从视神经头附近和沿上经络的不同视网膜偏心处获得的活体OCT体积重建,获得了人光感受器镶嵌体正面图像。
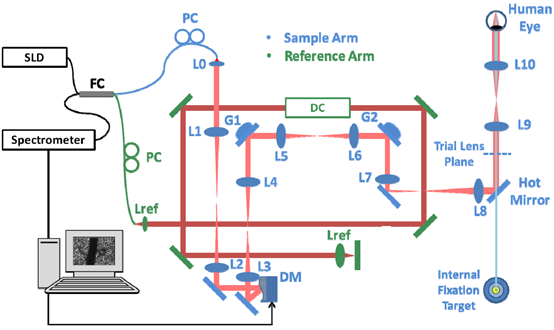

图1 WSAO-OCT系统示意。
结果
01-WSAO-OCT图像分辨率
在像差校正之前评估光学系统的质量。在样品臂中放置一个成像模型代替人眼,该模型由一个30mm焦距空气间隔消色差透镜和一个美国空军(USAF)分辨率靶标组成。用一个扁平变形镜给第6组和第7组靶标成像。采集的体积视图由1024×200×80个体素组成,以模拟成像条件。系统在空气中幻影的光斑大小为1/e2围度2.9μM,足以解析第7组的元素4(线宽2.76μm,图2)。

图2 使用分辨率目标和30mm焦距空气间隔消色差透镜,量化横向分辨率。可达到的横向分辨率为2.76μm,体积大小为1024×200×80。比例尺50μm。
02-使用WSAO-OCT成像人视网膜
作为性能演示,展示了在优化过程之前、期间和之后获得的图像。在WSAO优化前,用头部支架和固定靶稳定参与者。手动定位镜头L10以zuidahua感光层的强度。图3为优化Zernike模式3(散光)过程中的en face投影,来自参与者1。随着优化的进行,当找到最佳Zernike值时,B-scan和en face图像的强度逐渐增加到最大值(图3中step 6),在远离它时减小。Yellott’s ring在傅里叶变换图像中的可见度也遵循同样趋势。

图3 优化Zernike模式3(散光)期间的en face投影图像。光感受器图像在非散瞳瞳孔、约3.0°的偏心率下获得。视野为1.0°×0.4°。比例尺50μm。
图4为优化所有Zernike项之前和之后,从参与者1获得的en face锥状镶嵌体的比较。图像经相同处理,可以直接比较。优化后的en face图像更明亮,锥状镶嵌体清晰可见。
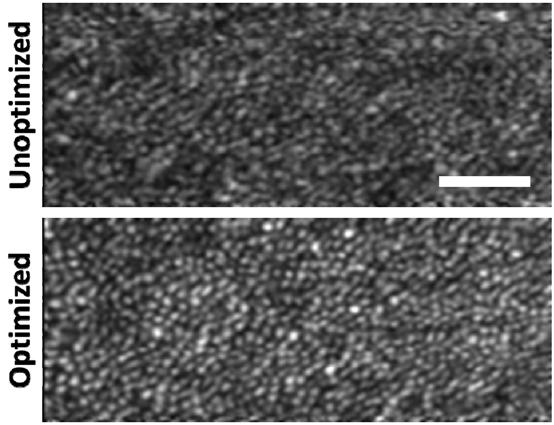
图4 参与者1视网膜偏心度约3.0°的视锥细胞图像。视野为1.0°×0.4°。比例尺50 μm。
完整记录了参与者2进行WSAO-OCT优化的过程。通过记录视频中10s未优化的内、外段(IS/OS)和视网膜色素上皮(RPE)层的en face图像。然后进行优化,可以观察到强度随增加趋势的周期性波动。在整个优化过程中,分辨率逐渐提高,直到单个锥状感光器可清晰地分辨为明亮的圆形结构。血管阴影作为确定参与者运动情况的标志,在运动程度较小的情况下,优化算法仍能够进行像差校正。
视频中WSAO优化前后的一组B-scan和en face图像展示于图5。en face图像通过IS/OS层(A-scan图上的第2层)内体素的最大强度投影生成。优化后的强度改善在A-scan的线轮廓(红框和绿框)上也很明显。每种模式中优化的Zernike系数的值(代表优化后的DM形状)以及相应的价值函数的增加如图5所示。
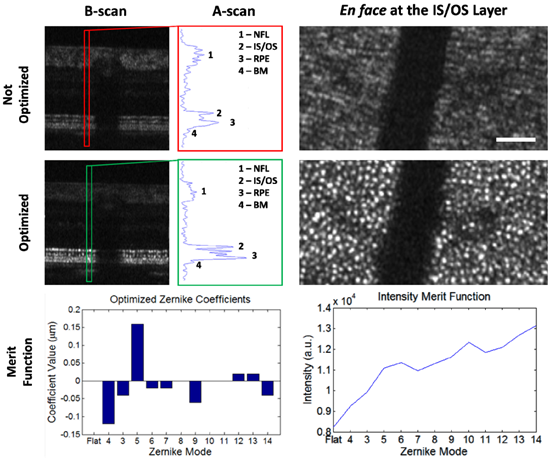
图5 WSAO优化前后en face图像中光感受器可见性的比较。左栏是B-scan的比较,右栏是在IS/OS层生成的en face图像比较。NFL:神经纤维层;IS/OS,内外段;RPE:视网膜色素上皮;BM:Bruch’s膜。en face图像视野为1.3°×0.6°。比例尺50μm。
为了证明该系统能够分辨中央凹附近的感光器镶嵌体,展示了从参与者2的四个不同视网膜偏心处获得的en face图像。图像在对相应视网膜位置的眼像差进行重新优化后获得。图6为在这些位置获取的未优化和优化en face图像间的比较。在未优化图像中,几乎无法从散斑图像中区分出锥状感光器。而优化后的图像对比度提高,在偏离中央凹接近1.0°处可以分辨出视锥细胞镶嵌体。en face图像中,中央凹位于左下角。
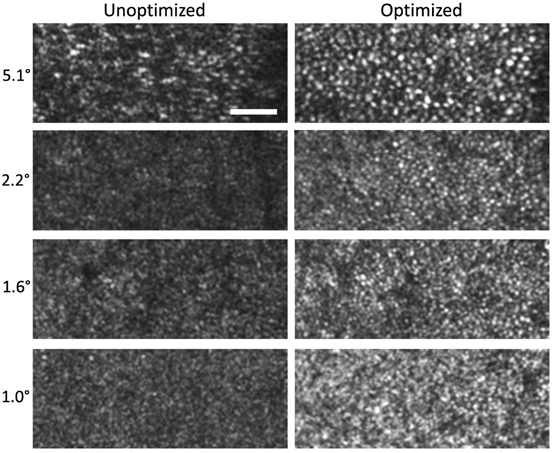
图6 在非水晶体瞳孔中沿上经络获得的视锥细胞镶嵌体图像。在四个视网膜偏心处获得以比较:5.1°、2.2°、1.6°和1.0°。视野1.0°×0.4°。比例尺50μm。
结论
本文使用基于透镜的光学成像系统和模态优化算法,结合超高速GPU处理平台,将WSAO-OCT实时用于人类视网膜成像。OCT获取人感光器镶嵌体图像且WSAO优化后,图像质量得到了提升。利用WSAO-OCT,在偏心率1.5°的情况下也能够可视化感光器镶嵌体。
在波前传感不可靠时,WSAO-OCT在细胞分辨率视网膜成像上有潜在优势。虽然WSAO-OCT的收敛时间比传统WFS成像慢(意味着它目前无法纠正泪膜动力学),但临床成像中,AO成像往往也存在其他障碍,如波前传感常受到波前传感器检测器的设计和性能影响、没有明确的AO参考面(在病变视网膜区域或视神经头上),且从成像系统光学表面反射的光也会有影响。临床中不规则瞳孔和视网膜结构、白内障或眼睛不透明增加也会影响波前数据的可靠性。在波前测量精度有限的情况下,WSAO-OCT有可能用于获得高分辨率图像,因为WSAO-OCT仅依赖于获得的图像,而不依赖于波前测量。
WSAO-OCT成像的另一个优点是,它不需要一个精确定义的共轭平面来进行波前探测。这一特征使WSAO-OCT能够在接近非平面的视网膜结构,如视神经头或yinbing理改变而扭曲的视网膜时,仍以高分辨率可靠地工作。
本研究采用WSAO-OCT系统与非散瞳参与者进行实验作概念验证,未来将进行一项与眼科临床医生合作关于散瞳患者的更大规模研究。为了适应临床环境,需要对现有系统进行一些修改:模态控制无波前传感器算法实现了快速优化,但与传统的基于传感器的AO眼科成像系统相比,它的收敛时间更长;WSAO优化过程中的运动伪影会影响像差校正的质量,任何由泪膜变化引起的眼像差微小波动都不能用本文报道的设置进行解释和纠正;虽然通过提高图像采集速率和减少校正的Zernike模式的数量,可将收敛时间缩短到6-12s,但仍需进一步改进。减少优化时间的一个可能方法是使用更快的成像系统,如兆赫OCT,将使当前的帧速率提高510倍。实时眨眼检测和/或瞳孔跟踪等算法改进也是减少运动伪影影响的潜在解决方案。
本文选择将重点放在光感受器层,以展示WSAO-OCT的能力。随着可用GPU的计算能力不断增长,可以添加一种实时分割算法,以实现特定层的像差校正。这也可能有利于可视化具有较弱散射特征的视网膜层,例如内核层和外核层。
为了提高横向分辨率和观察视网膜中较小的细胞结构,如视杆细胞和中央凹锥细胞,需要增加NA。这需要使用局部散瞳剂,如苯肾上腺素和托吡卡胺,以便能够用更大直径的光束成像。使用托吡卡胺的另一个好处是会使参与者眼睛的睫状肌麻痹,导致调节反射丧失,减少对优化算法的干扰。然而较高NA成像也会引入额外的眼像差,并且需要更大冲程的DM和更多节段,以便在低阶和高阶Zernike模式下成功校正像差。另外,一个用于将低阶和高阶Zernike模式分离到两个不同DMs的woofer-tweeter DM配置可以用来增强该实验装置的像差校正能力。
总之,本文展示了一种基于透镜的WSAO-OCT方法,该方法能够在较小偏心角内分辨人非散瞳眼中的视锥细胞镶嵌体,即使在small-stroke DM下也是。最重要的是,透镜WSAO设计复杂度的降低,有助于形成一个非常适合眼科临床的,稳健紧凑的成像系统。
参考文献:Wong, Ksk , et al. "In vivo imaging of human photoreceptor mosaic with wavefront sensorless adaptive optics optical coherence tomography." Biomedical Optics Express 6.2(2015):580-590.
