
mRNA从开创性发现研究到现今为止已经过去了七十多年,mRNA分子的不稳定性和免疫原性已经被大大改善,同时在一系列的应用中都展现出了治疗潜力。为了达到治疗效果,mRNA分子必须达到特定的靶细胞,因此对于mRNA递送材料是有一定要求的。
用于mRNA传递的脂质的发展
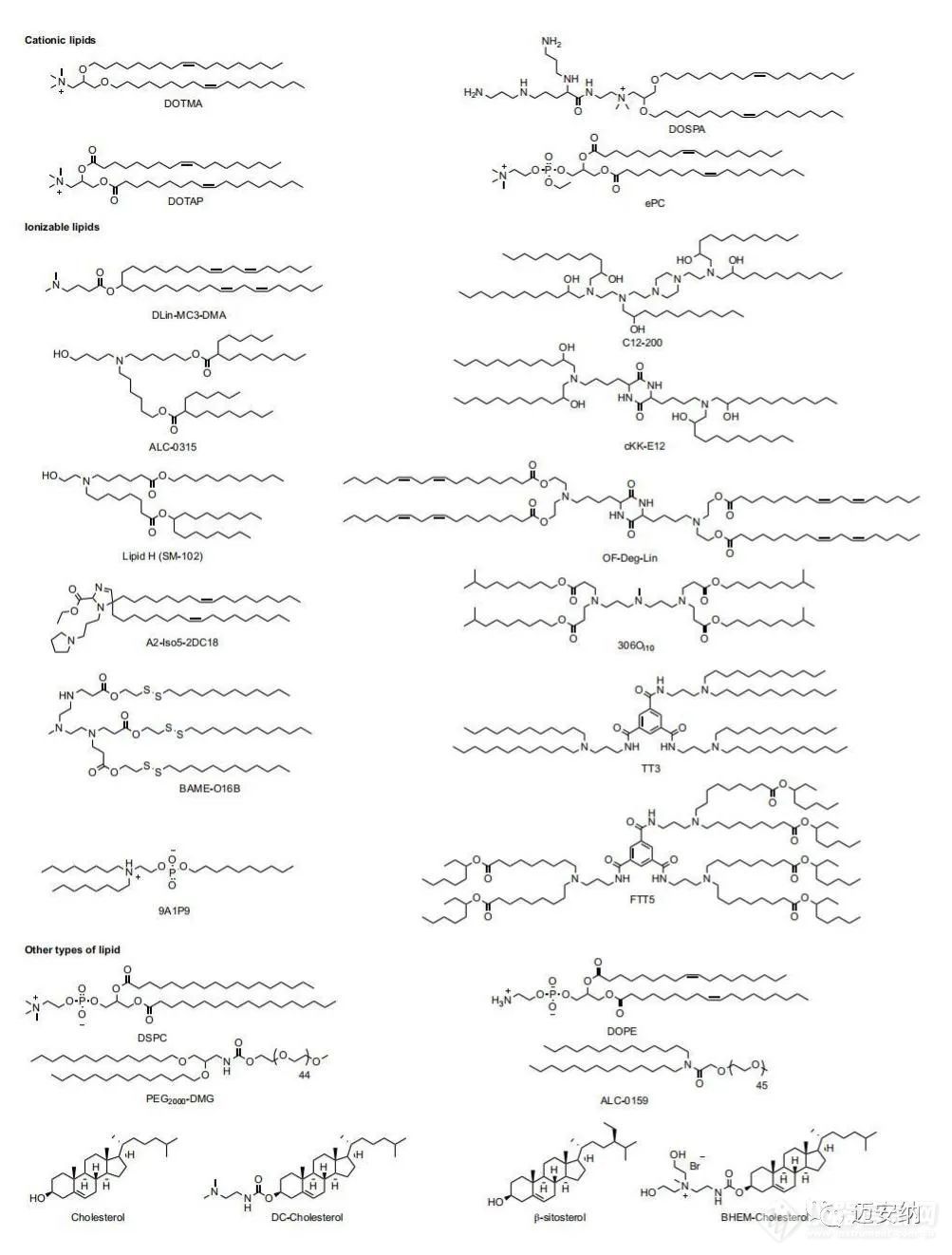
脂质是一种两亲性分子,包含三个结构域:一个极性头基,一个疏水尾部区域和一个连接体。已被研究用于mRNA递送的脂质包括阳离子脂质、可电离脂质及其他一些类型的脂质。
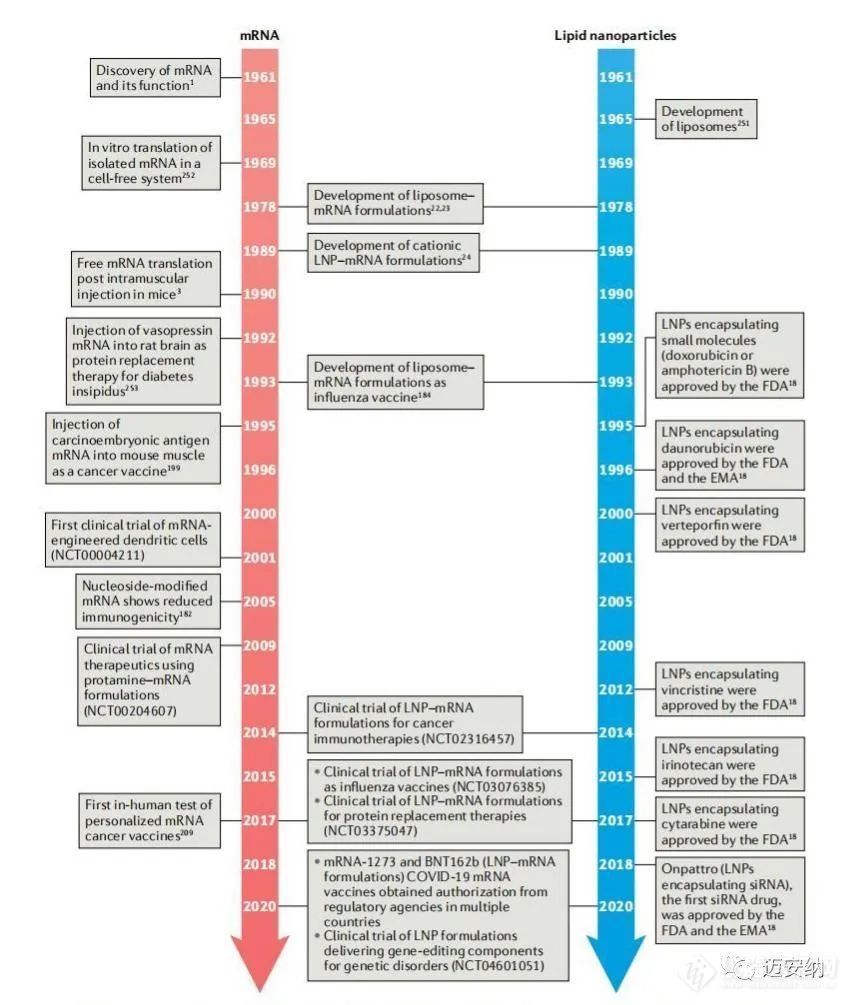
用于mRNA传递的脂质的发展
阳离子脂质
阳离子脂质是被研究探索商业化较多的脂质,例如基于epc的脂质纳米颗粒已被应用于mRNA的肿瘤免疫治疗;基于DOTAP的阳离子纳米乳剂可以递送抗病毒、细菌和寄生虫感染药物;DOTAP-聚合物混合纳米颗粒可以传递mRNA分子用于治疗肿瘤疾病,传染病和遗传疾病。另外在DOTAP脂质纳米颗粒中加入碳酸盐脂灰石,通过将纤维连接蛋白结合到脂质纳米颗粒上,可以进一步提高传递效率,这种细胞粘附蛋白的方式可以加速细胞内吞速率。
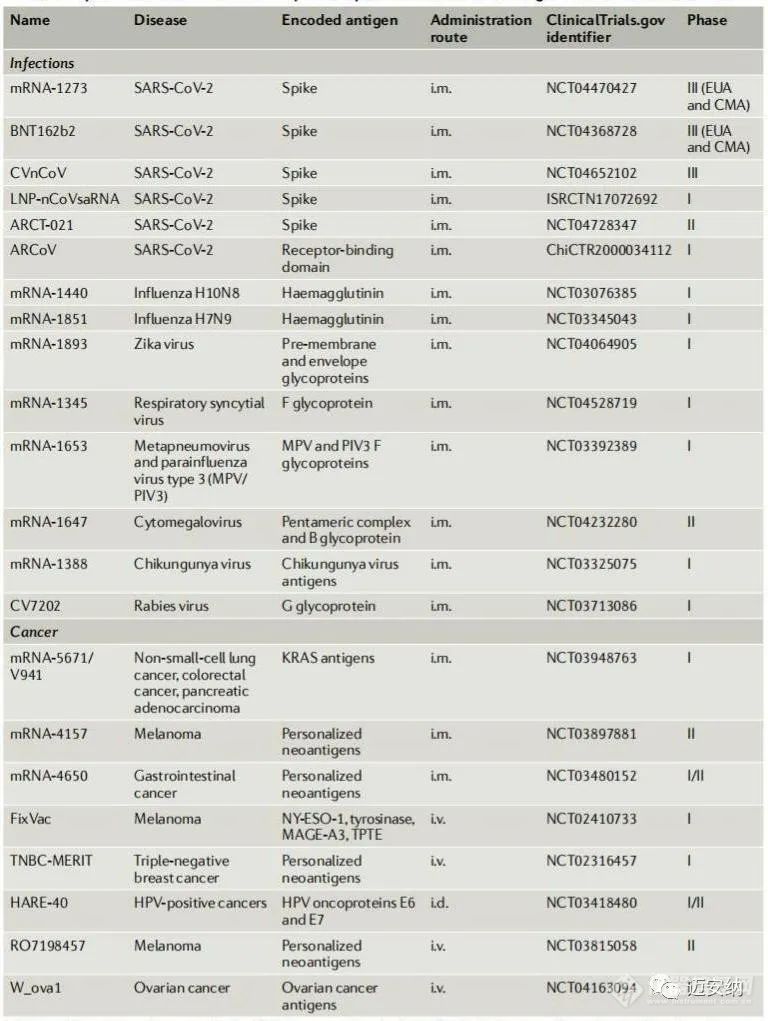
LNP-mRNA疫苗抗感染和癌症的代表性临床试验
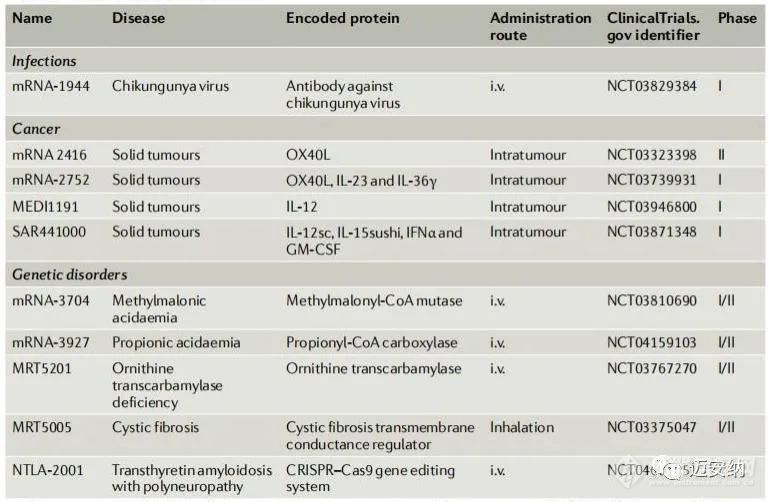
LNP-mRNA治疗感染、癌症和遗传性疾病的代表性临床试验
可电离脂质
另一种应用较多的脂质是可电离脂质。在低pH值下会被质子化,这使它们带正电荷,但它们在生理pH值上保持中性。可电离脂质的pH值敏感性有利于体内mRNA的传递,因为中性脂质与血细胞阴离子膜的相互作用较少,从而提高了脂质纳米颗粒的生物相容性,携带正电荷利于纳米颗粒从内体中逃逸。除了阳离子或可电离的脂质外,LNP-mRNA配方还包含其他脂质成分,如磷脂(如磷脂酰胆碱和磷脂酰乙醇胺)、胆固醇或聚乙二醇(PEG)功能化的脂质(PEG-脂质)。这些脂质可以提高纳米颗粒的性质,如颗粒的稳定性、传递效率、耐受性和生物分布。
LNP-mRNA配方需要克服多个阻碍才能实现体内有效表达。包括:2、配方在全身给药后应逃避MPS的拦截和肾小球滤过的清除。3、LNP-mRNA系统需要到达靶组织,然后由靶细胞内化。之后mRNA分子必须逃离内含体到达细胞质,在那里发生翻译。
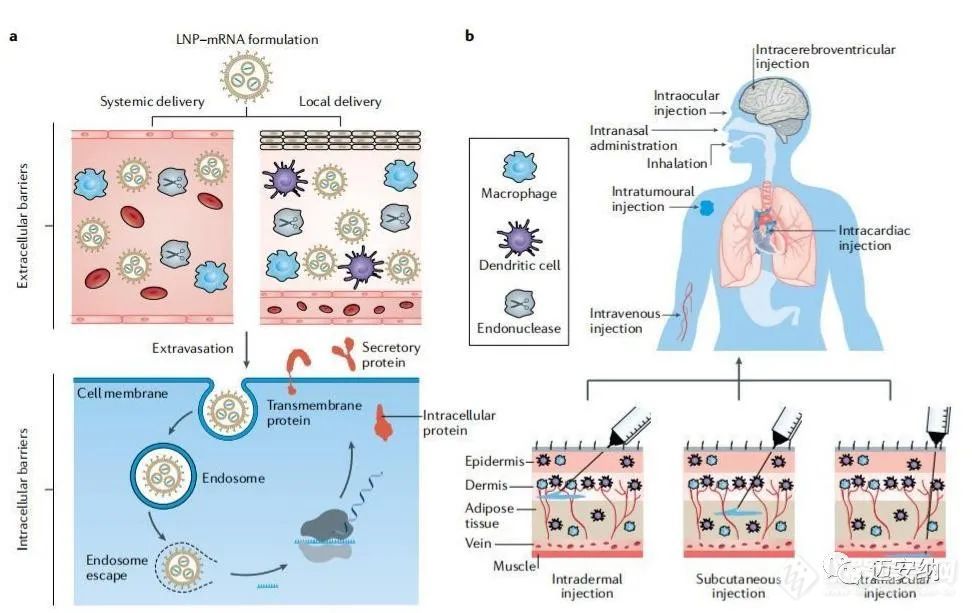
a为LNP-mRNA配方在递送过程中的障碍;b为LNP-mRNA的给药途径给药途径会影响LNP-mRNA配方的器官分布和治疗结果等多个方面。给药途径通常取决于纳米颗粒的性质和治疗适应症。在静脉注射给药后,许多脂质纳米颗粒可以在肝脏中积累,这可能会增加对mRNA疫苗的免疫反应。例如,静脉注射使用mRNA疫苗已被证明可诱导出更强的抗原特异性细胞毒性T细胞球。研究表明,LNP-mRNA疫苗可在耐受性良好时产生强大的免疫反应。另外疫苗接种也可以通过鼻内给药来完成,因为外周淋巴结中的APCs可以很容易地接纳药物配方。LNP-mRNA配方需要根据疫苗和作为治疗药物的不同特性制作来达到期望的治疗效果。主要需要考量的问题在于:1、GMP生产;2、稳定性和存储;3、安全性。
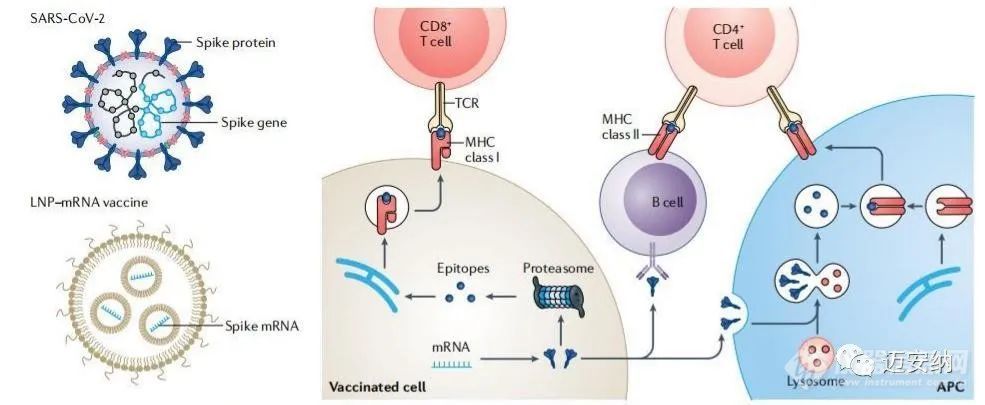
mRNA技术和基于脂质纳米颗粒递送系统的发展已成为对抗COVID-19的强大工具。根据临床研究的经验教训,LNP-mRNA配方可以被继续改良。通过RNA工程可以进一步提高mRNA分子的体内翻译效率。此外,具有电荷改变功能的可释放转运体和修饰的树状大分子可以在体内外有效地传递mRNA分子。天然来源的外泌体和细胞膜也可以应用于mRNA的递送。不同器官和细胞的递送可以通过调节脂质结构来实现。脂质纳米颗粒的设计还应考虑其生物降解性和多功能性。生物可降解的脂质能够从血浆和组织中快速清除脂质纳米颗粒,提高其安全性和耐受性。
总之,mRNA在许多临床试验和临床应用中都显示出了巨大的治疗潜力。下一代脂质纳米颗粒和其他类型的递送材料的发展将进一步使基于mRNA的治疗广泛的疾病成为可能,在未来拥有更加广阔的道路。
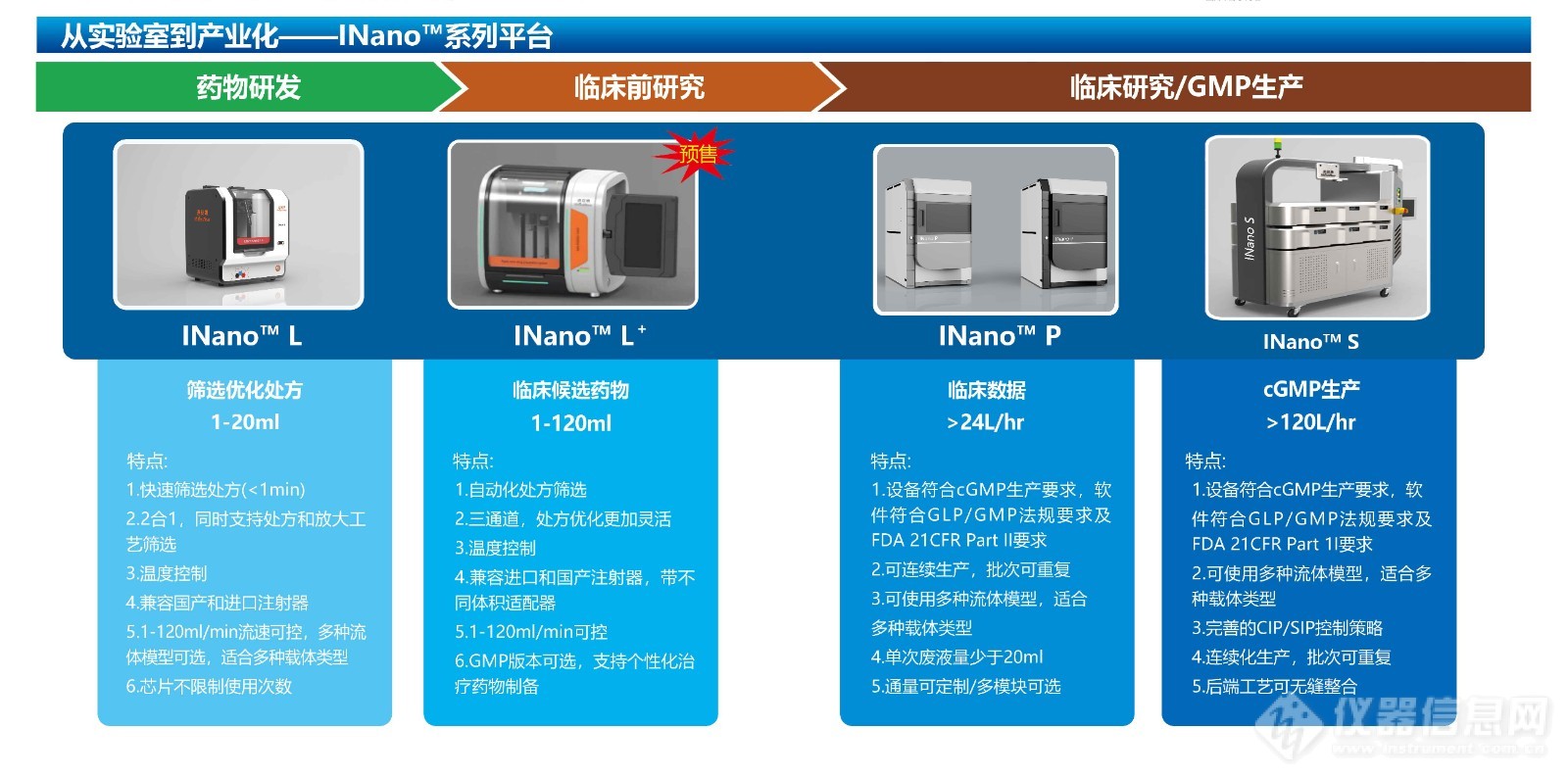
INano™快速纳米药物制备系统
关注我们的公众号了解更多↓↓↓↓










