近期,来自瑞士Friedrich Miescher Institute for Biomedical Research研究所的P. Liberali组与Viventis公司工程师合作,使用长时间高分辨类器官光片显微镜-LS2在bioRxiv上在线发表了题为Open top multi sample dual view light sheet microscope for live imaging of large multicellular systems的文章。这篇文章对该技术的核心细节进行详尽展示。
长时间高分辨类器官光片显微镜-LS2是由瑞士Viventis公司推出的一款全新光片成像平台,可实现活细胞的长时间、高分辨、高通量、多样品同时成像,非常适合对直径达300 μm的光敏样品(如卵母细胞,胚胎和类器官)进行长期实时高时空分辨率和低光毒性的观察与成像。该技术一经推出便已发布多篇Science/ Nature主刊 [1-5]。
长时间高分辨类器官光片显微镜-LS2肠道类器官成像效果
摘要:
多细胞系统会在数周内从单个细胞生长成为类器官、由数千个细胞组成完整组织,此类样品的实时成像一直具有挑战性。为了跨越这些长时间、空间尺度的难题,本文作者提出了一种开放式顶部双侧成像和双侧照明的光片显微镜,专门用于单细胞分辨率的发育过程中的大型样本的实时成像。作者使用新开发的光片显微镜对多种样品进行实时成像研究,结果突出显示了其在大型标本(如成熟的肠道类器官等)中获得定量单细胞信息的能力。

研究背景:
单个细胞发育成为复杂组织的动力学、可视化以及潜在分子机制的理解是细胞和发育生物学的首要目标。然而,这些复杂的生物现象往往跨越大的空间和时间生物学尺度,特别是类器官等体外模型系统,经常受到样品间异质性的影响。设计用于此类系统实时成像的显微镜需要在每个实验中提供高样品通量才能得出结论,且需要为光散射较大的样品提供足够的空间和时间分辨率和高图像质量,同时最大限度地减少光剂量并保持样品上样方便。目前,大多数的光片显微镜技术由于其低光毒性成为了克服上述一些挑战的技术方案之一。但这些技术仅限于每次实验仅对一个或极少数样品进行成像,且这些系统缺乏从对侧进行多视成像的可能性,不适合发育较大的样本。
文章亮点:
本文展示了一种开放式、双侧成像和双照明的长时间高分辨类器官光片显微镜-LS2。其结合了多视图光片显微镜的优点,具有开放式几何形状和多孔样品支架,可以对大型多细胞系统进行长期多位置3D实时成像。作者通过对小鼠肠道、肝脏和唾液腺类器官、类原肠胚、水螅和人结肠癌类器官的长期实时成像,展示了该系统在各种模型系统中实现高图像质量的能力,其尺寸可达550 μm,记录时间长达12天。此外,本文获得了跨生物尺度的定量特征,并通过对肠道类器官和类原肠胚的跟踪和分割提供了详细的单细胞分析,这是新开发的Viventis长时间高分辨类器官光片显微镜-LS2才能实现的。
详细数据:
本文展示的光片显微镜包含两颗相对的照明物镜(尼康10X, NA 0.2),每颗从水平面略微向上倾斜,从两个侧面照亮样品,两颗相对的成像物镜从两个方向成像(尼康16X, NA 0.8, 该系统也兼容尼康25X, NA 1.1)(图1)。这种几何形状在两个照明物镜上方创造了一个无阻的线性空间用于定制设计的多孔样本池(图1-2),该样本池包含多达四个可互换的样品室阵列, 用于多位置成像。浸入介质被放置在一个储层中,填充两个水浸入检测物镜之间的空间。 为了获得两个相对的光片以尽可能大的角度照亮样品,作者使用了超长工作距离的空气物镜, 通过玻璃窗将照明光耦合到浸入介质中,并设计了一个定制的校正三重透镜来补偿球面和色差。物镜区域是具温度控制的,样品被封闭在一个控制CO2浓度的隔间中。额外的光束路径是使用其中一个检测物镜作为聚光镜来照亮样品并获取透射光图像。为了以最佳方式安装不同的生物样品,作者在热成型过程中开发了由氟乙烯丙烯(FEP)箔制成的可定制腔室。该腔室适合于两颗检测物镜之间的6毫米空间区域,并允许从顶部加液、移液,满足不同生物样品的活细胞培养要求。
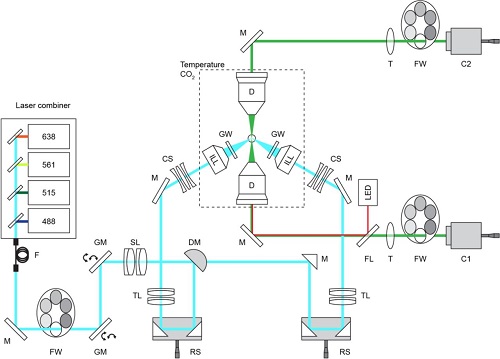 图1 长时间高分辨类器官光片显微镜-LS2光路图
图1 长时间高分辨类器官光片显微镜-LS2光路图

图2 长时间高分辨类器官光片显微镜-LS2物镜及样本池视图
在作者之前的工作中,使用了本文所介绍的显微镜的前身,上一代技术的显微镜只构建了一个检测物镜来跟踪发育中的肠道类器官中的细胞。 然而,所提供的成像深度不足以跟踪较大标本中的细胞,包括成熟的类器官。新设计的双成像物镜、双侧照明方法克服了这一障碍。 作者使用细胞周期报告基因FUCCI2,在3天的时间过程中对成熟小鼠肠道类器官的隐窝和绒毛形成进行成像(图2和视频2)。 在隐窝和绒毛形成的背景下监测细胞周期状态。 使用多位置成像,同时获得了多个类器官的数据集。单细胞分辨率的双色成像深度为360µm, 时间分辨率为10分钟(视频1),以非常细致的细节显示发育中的小鼠肠道类器官的整体动力学。整个单细胞的可视化样本量要求通过双侧成像实现高图像质量。我们通过将单个检测物镜的XZ部分与融合数据进行比较来说明这一点(图2)。 随着成像深度的增加, 单个视图的切片显示出预期的退化,而融合的数据由两个视图的最佳质量组合组成,并且能够在整个体积中绘制单个细胞(视频2)。这种策略对于整个样本的3D成像是十分必要的。
为了进一步评估使用两个相对的成像物镜对图像质量的改善,作者通过计算两个物镜的每个z截面的离散余弦变换DCT来比较图像质量随成像深度的增加。例如,对肠道和人类结肠癌类器官进行了比较(图3)。两种模型系统都显示,随着成像深度和距离检测物镜的距离增加,图像质量明显下降,这可以通过组合来自两个相反物镜的数据来补偿。综上所述,双重检测物镜对于保证大样本的高图像质量的重要性。
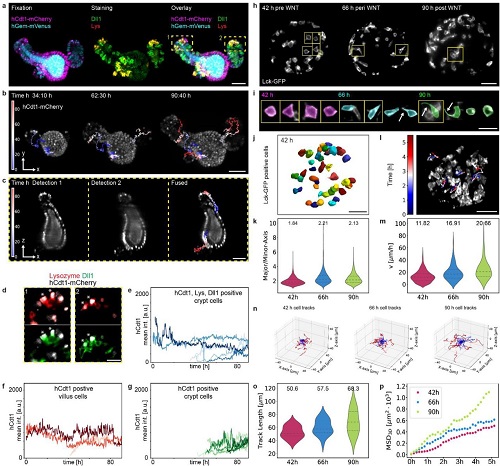
图3 肠道和人类结肠癌类器官成像及单细胞分析
为了说明新发布系统的高性能,作者对尺寸从200µm到550µm的多种样品进行了成像,并进行了长达12天的连续成像:小鼠肝类器官,人类结肠癌类器官,小鼠腮腺唾液腺类器官,和类原肠胚。此外,新发布系统的样品安装策略不仅支持各种不同标本的开发,而且可以进行平行化学扰动的实验。在相同的成像实验中,四个腔室中的每一个都可以用于特定的条件,每个腔室内有许多单独的位置成像。我们分析了PGE、Forskolin和NaCl诱导的高渗休克对肠道类器官的机械渗透作用。3分钟的高时间分辨率(视频3)显示了对各自治疗的快速类器官膨胀和收缩。
平行的PGE、Forskolin和NaCl对肠道类器官的影响
此外,为了证明新发布显微镜的多定位能力,作者以10分钟的时间分辨率对25个成熟的肠道类器官进行了平行成像,每个类器官的体积为360 µm(视频4)。
总结: 本文作者提出并发布了一种双侧成像、 双侧照明的光片显微镜,适用于单细胞分辨率下对多种大型生物模型系统(如肠道类器官等)进行长期多位置成像,质量适合于整个类器官的细胞分割和细胞跟踪。特殊的物镜配置使得使用多孔样品池可以同时监测多个实验条件。通过采用热成型工艺制造各种形状的样品池实现了样品特定和灵活的上样。未来,具有这种物镜配置和样本池配置的光片显微镜将进一步成为技术进步的有前途的平台。
参考文献:
[1] Naganathan et al., Left-right symmetry of zebrafish embryos requires somite surface tension. Nature
[2] So et al., Mechanism of spindle pole organization and instability in human oocytes. Science
[3] He et al., Lineage recording in human cerebral organoids. Nature Methods
[4] Serra et al., Self-organization and symmetry breaking in intestinal organoids development. Nature
[5] Dumortier et al., Fracking and Ostwald ripening position the lumen of the mouse blastocyst. Science




.png)
