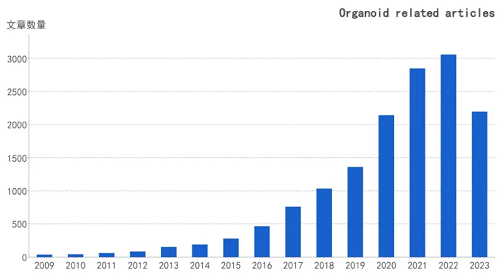
类器官(Organoid)是十四五国家重点研发计划中6个重点专项之一,是国家科技部的重点关注项目。近年来相关的项目和文章也迅速升温,仅过去的2023年上半年,“Organoid”相关文章就有两千多篇,远超前几年同期水平,意味着该领域的研究热度持续上升。
国自然基金申报 “内卷”趋势越来越显著,而类器官(Organoid)作为前沿热点技术之一,近年来备受申请人和评审专家们的关注。类器官相关的课题和项目在申请国自然上具有得天独厚的优势。尤其是2018年以来,类器官相关方向,连续几年被国自然申报指南列为推荐项目的研究方向。作为具有高适用度的体外模型之一,类器官从最初的体外模型补充参考的工具,逐渐开始“挑国自然大梁”。
PubMed类器官相关文章数量趋势
近期,一篇以《人脑类器官中的谱系记录》(Lineage recording in human cerebral organoids)为题的类器官文献登上Nature Methods。该文献结合单细胞测序、空间转录组以及4D光片显微成像技术(长时间高分辨类器官光片显微镜),实现了人类大脑类器官的谱系记录。
近年来,人类诱导多能干细胞iPSCs衍生的类器官,为研究人体器官发育提供了模型。单细胞测序技术能够高度鉴定系统内细胞状态的描述,然而,目前还没有很好的方法直接测量细胞谱系关系。谱系偶联scRNA-seq允许在复杂组织和其他细胞分化场景中更好地注释细胞命运规范和轨迹推断。长时间高分辨类器官光片显微镜基于图像的方法,为捕捉全面的发育动态提供了一种可视化方法。因此,谱系偶联单细胞转录组学和长时间高分辨类器官光片显微镜为记录和理解iPSCs建立的类器官系统的谱系动力学提供了全面的解决方案。
长时间高分辨类器官光片显微镜-LS2是一款全新光片成像平台,可实现活细胞的长时间、高分辨、高通量、多样品同时成像,非常适合对直径达300 μm的光敏样品(如卵母细胞,胚胎和类器官)进行长期实时高时空分辨率和低光毒性的观察与成像。这一成熟的长时间实时类器官成像技术也为本实验提供了关键数据支撑。
作者建立了一个双通道细胞谱系记录系统(iTracer) 来了解脑类器官脑区域化过程中的谱系动力学。系统设置从最原始的iPSCs样本库中开始跟踪克隆,同时也允许使用诱导疤痕在不同的时间点进行谱系记录,以解决动力学与神经元命运之间建立关系尚不明确的问题。该系统既可以进行克隆分析,也可以探索细胞命运建立的时间动态,避免了多轮标记。在脑类器官发育的时间过程中进行的单细胞转录组分析证实,在单个类器官中形成了不同的脑区域,类器官中的脑区域特征与发育中的小鼠大脑空间原位地图集的对应区域非常相似。使用iTracer来探索在脑类器官模式和神经发生过程中与分子特征相结合的谱系,并表明该系统与空间转录组学兼容。
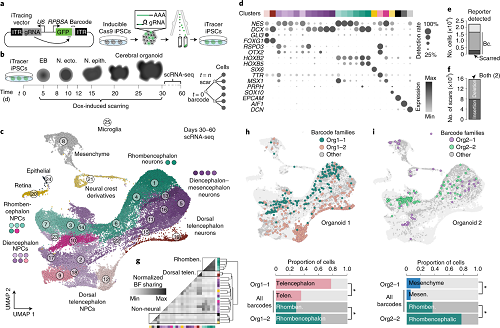 图1 iTracer Sleeping Beauty示意图并且揭示了人类大脑类器官细胞命运的克隆性
图1 iTracer Sleeping Beauty示意图并且揭示了人类大脑类器官细胞命运的克隆性
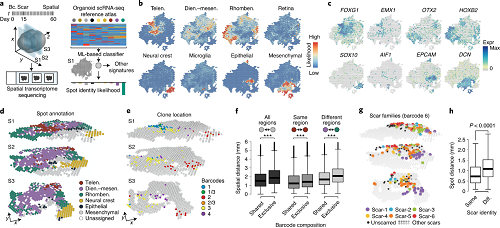
为了将分子状态、细胞谱系和位置信息联系起来,作者建立了“空间iTracer”,它使用空间转录组测序技术来测量基因表达和iTracer读取结果。数据表明,在脑类器官发育过程中,相关细胞倾向于聚集在类器官的同一区域,接收相似的图案信号,因此平均而言被限制在相同的大脑区域身份中。iTracer和空间iTracer共同揭示了脑类器官不同脑区细胞克隆的富集,这可以追溯到初始化EB 内的克隆。
图2 空间iTracer连接脑类器官的谱系、分子状态和位置信息
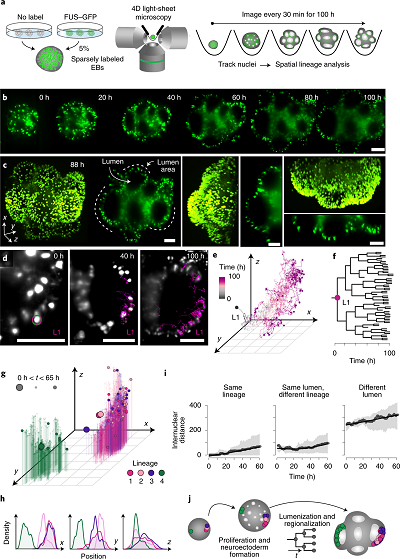
为了直接测量神经外胚层到神经上皮阶段发育中的类器官的谱系动力学和克隆的空间积累,作者使用4D光片显微成像技术(长时间高分辨类器官光片显微镜)建立了发育中的脑类器官的长期实时成像(图3a)。简单地说,作者生成了含有5% iPSCs的类器官,其细胞核被FUS-mEGFP荧光报告标记,将EB嵌入成像室的Matrigel中,并在神经诱导培养基中培养,类器官使用Viventis Microscopy开发的LS1 Live光片显微镜成像,使用X25物镜,每2 μm获得连续z步,共150步。采集帧率为30分钟,总共100小时(200帧)用于跟踪。并跟踪发育 65-100小时(图3b)。随着EB的生长和发育,观察到几个管腔的形成,每个管腔都可以在三维上跟踪(图3c)。
图3 脑类器官发育的长时间高分辨类器官光片显微镜4D成像
在整个记录时间内,作者使用Mastodon直接跟踪单个细胞核的谱系,这是一个允许在大型4D数据集中半自动跟踪和管理细胞核谱系的方案(图3d,e)。他可视化了源自原始细胞核的子细胞的空间分布,称之为谱系1 (L1),并生成了100小时增殖后的谱系树(图3f)。一个细胞周期的平均持续时间估计为17.3小时。作者观察到,在整个记录时间内,L1仍然局限于腔内的同一区域(图3d)。跟踪了另外三个核,其中两个核与L1 (L2-L3)在相同的管腔区域相邻,第三个核(L4)位于EB中一个截然相反的未来管腔区域(图3g)。作者量化了每个树之间的空间距离,并检查了类器官3D空间内所有子细胞的分布(图3g-i)。在65小时的过程中,初始化细胞核平均产生13个后代细胞核,它们都填充在扩大的类器官中,但在空间上仍然局限于亲本管腔,表现出有限的远离其谱系成员的迁移(图3g-i)。这些结果表明,克隆的早期空间排列随后的局部扩增导致脑区域的不同谱系组成,这证实了之前基于iTracer的类器官脑区域克隆性观察(图3j)。
另外,作者还使用iTracer来确定细胞在脑类器官发育过程中何时限制了它们的命运。研究者使用谱系记录器的两个通道(在EB初始化和发育过程中诱导的疤痕中引入的条形码)以及单细胞转录组来构建命运映射的全类器官系统发育。使用iTracer以高分辨率评估不同脑类器官区域中祖细胞到神经元谱系的可变性。为了实现深层谱系采样,他们对200 μm iTracer类器官切片的两个微解剖外周区域进行了谱系偶联单细胞转录组学。
作者整合了静态序列标记和基于CRISPR 技术的动态序列标记,可用于标记起始时间点的不同干细胞,也包括基于 CRISPR 编辑系统的动态序列标记,结合带有可诱导 Cas9 蛋白基因的干细胞,即可在特定时间点产生额外的随机突变,从而得到第二层细胞谱系信息。通过使用4D光片显微成像技术(长时间高分辨类器官光片显微镜),对稀疏核标记的大脑类器官进行追踪观察。而在此基础上,通过在不同时间点引入动态序列标记,还可得到大脑类器官中不同细胞类型、特别是不同类型神经元的命运决定关键时间点,并对同一多能干细胞产生的不同后代神经元的分化情况进行比较。进而得出在分裂分化过程中,大脑类器官的细胞并未发生显著的细胞迁移,因而其后代细胞呈聚集分布,并在类似的微环境作用下,被诱导为同样类型的神经元。
未来,iTracer以及4D光片显微成像技术(长时间高分辨类器官光片显微镜)的联合应用将成为了解人类类器官系统发育障碍背后的突变影响的有力方法。
参考文献:
[1]. He et al., Lineage recording in human cerebral organoids. Nature Methods