CD4+ Th细胞激活后分化为功能不同的Th1和Th2效应细胞,Th1细胞分泌IL2、IFNγ、TNFβ等介导细胞免疫应答、迟发型超敏反应和器官特异自身免疫性疾病在宿主抗胞内病原感染中起重要作用。Th2 细胞产生IL4、IL5、IL6、IL9、IL10、IL13等细胞因子介导体液免疫应答、过敏性和感染性疾病在拮抗胞外病原体(如细菌、寄生虫) 、B 细胞增殖分化以及哮喘病等方面具有重要作用。近年来,人们对初始CD4 +T细胞分化为Th1或Th2细胞的机制进行了广泛而深入的研究,已取得一些共同的认识:双信号刺激活化CD4+T细胞,活化信号传向胞内、启动多条信号转导通路,激活转录因子、继而转录因子结合到目的基因的启动子区、促使原癌基因、细胞因子基因及其受体基因表达。细胞因子可经自分泌和旁分泌作用促使T细胞克隆扩增,之后分化为功能各异的Th1和Th2 效应细胞,部分分化为记忆细胞。在Th细胞分化过程中,细胞因子被认为是zui主要的因素。
- 、TCR 和协同刺激信号
1.1TCR- CD3
TCR与MHCⅡ:抗原肽复合分子的结合为T细胞激活所需的*信号。TCR2CD3 激活后,CD3 的免疫受体酪氨酸活化基序( Immune receptor tyrosinebased activation motifs,ITAM) 可转导胞外刺激信号。研究发现,在无IL4和IL12的T细胞分化早期,TCR 活化信号影响Th1PTh2 的分化决定:MEKPERK激活、Ca2 +流增加驱使T细胞向Th1 分化;PKC激活或钙调磷酸酶部分阻断则驱使T细胞向Th2分化。另外,弱TCR 活化信号能激活Ca2 +流信号诱导IL4合成,促使T细胞向Th2分化;强TCR活化信号可激活MAPK通路诱导IFN2γ合成,促使T细胞向Th1分化。TCR 触发时间的长短也影响Th细胞的分化;IL12存在时,短暂的TCR触发启动Th1分化,长时间的TCR触发则启动Th2 分化。
1.2 CD4
CD4 为T细胞的辅助受体,在T细胞活化早期能与MHCⅡ类分子结合,并通过蛋白酪氨酸激酶LcK转导信号,LcK缺失的CD4+T细胞可出现Th2分化障碍,Tec家族激酶Rik 和Itk (Lck 下游分子)在Th2分化过程中亦起重要作用。
1.3 CD28及其同系物
CD28 与活化APC 上的B7.1 (CD80) 或B7.2(CD86)的结合为T细胞活化提供第二个信号。IL4、IL5 以及IL10的产生需要CD28 协同刺激,CD28能增加胞内转录因子NF-AT2 (nuclear factor of activated T cells 2)的累积,缺失时CD4 + T细胞仅分泌IFNγ。B7分子敲除的APC实验研究亦证实IL4 的产生和Th2分化高度依赖于B7 ,而有实验发现CD28能导致膜脂质微小区域的重组和持续的酪氨酸磷酸化,但CD28介导Th2分化的分子机制目前尚不清楚。zui近,Skapenko等发现记忆T细胞CD28 能启动IL4基因转录,并激活PI3激酶、JNK-SAPK以及p38 MAP通路,CD28-B7诱导Th2分化要依赖于IL4的表达、p38 以及ERK-MAP通路的激活。因此,CD8可能可以放大诱导Th2分化的TCR 活化信号。
CTLA4是CD28的同系物,表达于活化T细胞,与B7结合的亲和力是CD28的10倍,缺乏CTLA4可出现多克隆T细胞激活增殖紊乱。CTLA4敲除T细胞能分泌高浓度IL4和IL5,提示CTLA4 在Th2分化诱导中起下调CD28的作用。
诱导性协作刺激因子( inducible costimulator ,ICOS) 是近来发现的CD28同系物,亦表达于活化T细胞。与CD28 和CTLA4 不同的是, ICOS 不与B7结合,而与B7RP1 (B7 的同系物之一) 结合。ICOS缺失小鼠T细胞分泌的IL4明显降低,而IFNγ未见异常。因此,ICOS 能潜在地调节T 细胞的分化发展。
众多来源的IL4 能通过STAT6 诱导Th2分化,但zui初驱使分化的IL4 源自何处,目前尚不清楚。IL4 基因定位于11号染色体,此部位还有IL5、IL13 基因。在IL4 和IL13 基因位点处发现了与Th2分化相关的几个DNA 酶I高敏感位点,提示:在Th2分化时伴随有这些Th2型细胞因子基因位点的染色质重组。已证实核小体上组蛋白的高乙酰基化与IL4、IL5、IL13等基因相关,且这种Th2特异的高乙酰基化依赖于STAT6 和GATA3 ,并伴随IL4、IL13基因的转录表达。目前在IL13 基因位点上游1. 6kbp处, 发现了一段保守的GATA3 反应元件(GATA3 response element ,CGRE) 序列,它能与GATA3、组蛋白乙酰基转移酶复合物以及RNA 聚合酶Ⅱ结合,并具有增强上述Th2 型细胞因子基因启动子的作用。通过对IL4 基因启动子的研究,亦发现多个与IL4 基因表达有关的转录因子,如NFAT2AP1、GATA3、cmaf以及JunB 等。另外, IL13 能与IL4 受体α链结合,调节Th2 分化; IL26 能上调细胞因子信号抑制分子1 ( suppressor of cytokine signaling1 ,SOCS1) 表达而抑制Th1 分化,同时促进活化CD4+T 细胞分泌IL4 诱导Th2 分化。
3.1 NF2AT
NF2AT家族有5个成员:NF2AT1 (NF2ATp) 、NF2AT2 (NF2ATc) 、NF2AT3、NF2AT4、NF2AT5 ,均有高度保守的DNA 和钙调磷酸酶结合位点。前4者位于胞浆中,NF2AT5 则位于胞核内。钙调磷酸酶磷酸化介导NF2AT 的核内转运,而RasPRaf2MEK2ERK等蛋白激酶的激活使得NF2AT 与AP21 结合,形成NFAT2AP1复合物与DNA 结合。许多表达于活化T 细胞的基因启动子或增强子处均存在NF2AT 结合位点,如IL2、IL4、IL25、IFNγ 等。敲除NF2AT2 的小鼠,IL4 等Th2 型细胞因子表达受抑制,呈现Th2 分化缺陷,敲除NF2AT1 或同时敲除NF2AT1 和NF2AT4 小鼠却出现截然相反的结果。这说明NF2AT1、NF2AT2 能与IL4 启动子的NFAT2AP1 位点结合,功能各异地调节IL24 转录。Porter 等报道, ERK1、JNK3、p38α参与了NF2AT的磷酸化调节,并能抑制NF2AT2的核转运。
3.2 GATA23
GATA23 属于GATA 家族,表达于初始CD4+ T 细胞和朝Th2分化的Th0细胞,是Th2 分化调节的重要转录因子。过度表达GATA23 的转基因小鼠T 细胞能表达IL4、IL5、IL6、IL10 和IL13 等Th2 型细胞因子mRNA,通过反义技术抑制GATA3 表达,这些Th2 型细胞因子mRNA 的表达亦受抑制。然而,IL4 基因近侧启动子区并不存在GATA23 结合位点,因此有人认为GATA23 可能是一个Th2 特异的增强子,或是作为一个局部控制区域(如在IL4、IL5、IL13 区域) 存在。
在STAT6 敲除的T 细胞中, GATA23 亦能诱导Th2 型细胞因子表达,导致Th2 分化,并在IL4 基因定位处发现Th2 特异的DNA 酶I 高敏感位点;同时,GATA3 能与NF2AT 结合而诱导IL5 启动子的活性。近来研究发现一种称为FOG ( Friend of GATA) 的结构分子,该分子表达于初始Th 细胞,起抑制GATA23 的作用。
3.3 c2maf
c2maf 是基本区域P亮氨酸拉链(basic region/leucine zipper) 转录因子,特异表达于Th2 细胞,是zui早被克隆的Th2 特异性转录因子。以往认为,c2maf激活后不影响其它Th2 型细胞因子的表达,只是通过选择性地与IL24 近侧启动子结合,诱导IL24 表达促使Th2 分化。zui近,哈佛医学院的研究人员发现,c2maf 亦可通过IL22Rα(CD25) 介导但不依赖IL4 的途径促使Th2 分化。c2maf 灭活或敲除时,Th2 分化和相应细胞因子分泌照常进行,推测可能与IL13的补偿作用有关。
3.4 T-bet
T-bet (亦称T-box 21) 能激活IFNγ表达,是新近发现的Th1 特异性转录因子。T-bet 能诱导IFN-γ等位基因染色质重组和转录激活IFN-γ基因,亦能诱导IL12Rβ2亚单位表达,促使Th1 分化。若将T2bet导入已分化的CD4 Th2 细胞,出现IFN2γ分泌增强,IL4、IL5 等Th2 型细胞因子产生受阻,细胞朝Th1分化。研究发现,T2bet 诱导的Th1 分化不依赖于IL12-PSTAT4 或IL18 , 但受IL4-PSTAT6 的抑制。然而,STAT 与T2bet 之间的关系目前尚不清楚。
3.5 CPEBP 和JunB
与c2maf 类似,CPEBP 家族成员(如CPEBPβ) 亦能与IL4 启动子结合,是内源性IL4 表达的潜在诱导因子。同时,CPEBP 亦能抑制IL22 和IFN-γRNA 的合成,但不影响其它Th2型细胞因子。JunB 属于c-jun转录因子家族,选择性表达于Th2 效应细胞,能与AP21 特异结合,激活IL-4 转录。JunB 介导的IL-4 表达需要JNK激酶和c2maf 的协作,并能诱导分化中的Th2 细胞产生IL-5、IL-6 和IL-10。
4.1 JAK-STAT
JAK-STAT 是细胞因子受体介导的主要信号转导通路。IL-12 能通过STAT4 介导Th1 细胞分化, IL-4 可通过STAT6 介导Th2 细胞分化。然而,STAT 介导的目的基因尚不清楚,在IL-4 启动子附近亦未发现STAT 结合位点。尽管STAT4 或STAT6 基因敲除实验显示IFN-γ或IL-4依然正常分泌,但缺少STAT信号时GATA23、T-bet 以及细胞因子的表达则大受影响。推测STAT 与GATA23、c2maf 、T2bet 等转录因子密切相关,阐明这些内在的有助于搞清Th 细胞分化的分子机制。Bcl26 由于能与STAT6 竞争相同的结合位点,被认为是Th2的负向调节因子。新近发现SOCS5 能通过与IL-4R 的相互作用,负向调节IL-4PSTAT6 通路,从而抑制Th2 分化。
4.2 MAPK
哺乳动物的MAPK信号通路包括细胞外信号调节激酶(ERK) 、c-Jun N 端激酶(JNK)P应激激活的蛋白激酶(SAPK) 、P38MAPK 以及ERK5PBMK1 四条途径。每条通路均通过保守的三级酶促级联反应[MAPKKK→MAPKK(MKK) →MAPK]激活转录因子,调节特定基因的表达。ERK位于癌基因Ras下游,Ras等不同激活信号通过Raf2MEK1 途径激活ERK,通常称Ras2ERK通路,包括ERK1 和ERK2。前已述及TCR 激活信号能激活MEKPERK,促使Th1分化。H2Ras 转基因小鼠研究却发现,Ras2ERK通路经非TCR 激活信号激活后,能上调JAK1激酶活性,促进STAT6 酪氨酸磷酸化,并提示Ras-ERK与JAK-STAT通路之间存在交叉。可见,Ras2ERK通路与Th 细胞分化的确切关系尚待研究。
p38蛋白有4种亚型:p38-α、p38-β、p38-γ和p38-δ。MKK3、MKK6 是其主要的蛋白激酶,应激或炎症刺激等情况下可被激活。p38激活后的直接底物为MAPK激活的蛋白激酶(MAPKAPK)22P3 ,其目的基因启动子中含有CRE 或能与CREBPATF 和AP21 家族相互作用敏感的反应元件。p382α、MKK3P6等转基因动物实验发现抑制p38MAPK 通路的激活,IFN2γ水平明显下降。由于IFN2γ启动子近侧和远侧功能性活化元件处存在c-junPATF2 结合位点以及一系列其它ATF结合位点,且近侧IFN2γ元件携带c-junPATF2 结合位点, 呈现Th1 特异性。因此,p38MAPK通路可能通过激活IFN2γ 转录,促使Th1细胞分化。
JNK亦是一种应激激活的蛋白激酶,包括JNK1P2P3。激活的磷酸化级联反应为MEKK1 ,2 →MKK4PSEK1 →JNKPSAPK(MKK7 亦能激活JNK) 。JNKPSAPK能使c2jun、ATF22 等磷酸化并增加其转录活性,促进c-fos、c-Jun、ATF22 调节基因的表达。JNK2 基因敲除研究发现小鼠IFN2γ水平降低,Th1 免疫应答缺陷,但Th2 免疫应答不受影响。将IFN-γ 加入JNK2缺失的T 细胞中则能恢复上述缺陷,产生正常的Th1免疫应答。JNK1 敲除的小鼠呈现强烈的Th2 免疫应答,即使在Th1 条件下亦产生大量IL-4、IL-5 和IL10 等Th2 型细胞因子,进而发现JNK1 敲除小鼠核内NF-AT2 水平上升,提示JNK1 能负向调节核内NF2AT2 的水平,从而影响Th2 型细胞因子产生。
4.3 NF-κBPI-κB
正常情况下,NF2κB 与其抑制因子I-κB 存在于胞浆中。随着上游激酶(NF-κB诱导激酶或MEKK1) 的激活,I-κB 激酶活化并出现I-κB 蛋白磷酸化,导致它们与NF-κB 分离并降解,而游离的NF2κB则转入胞核内转导激活目的基因。NF-κB 因子在Th细胞分化中的作用研究目前刚起步。已有研究发现,抑制NF2κB 活性可阻断GATA23 表达和Th2 型细胞因子产生。
5、 结语
细胞分化过程本质上是细胞基因的按序表达和选择性表达的结果,因此,细胞分化调控的基本规律就是基因表达调节。对于Th 细胞分化而言,zui终表现为控制细胞应答的有关基因的活化与表达,细胞信号转导通路在此起了重要的中介作用。近几年,Th 细胞分化机制研究进展迅速,已认识到TCR 活化信号、辅助受体以及细胞因子环境等因素共同介导了Th1PTh2 细胞的分化方向,并逐步深入到转录因子、信号转导、基因调控水平。我们相信,Th 细胞分化的复杂性、调节的性以及信号通路和相关因子的交叉性等问题的zui终阐明,必将给免疫性疾病的药物治疗带来重大突破。

相关通路指标:
T-Cell Activation:
Regulators of T-Cell Activation: CD2, CD276, CD47, DPP4, CD3D, CD3E, CD3G, CD4, CD7, CD80, CD86, CD8A, CD8B, FOXP3, ICOSLG, IRF4, LAG3, LCK, MAP3K7 (TAK1), MICB, NCK1, TNFSF14, VAV1.
T-Cell Proliferation: CD28, CD3E, ICOSLG, IL1B, IL10, IL12B, IL18, NCK1, RIPK2, TNFSF14.
T-Cell Differentiation: ADA, APC, BCL2, BLM, CD1D, CD2, CD27 (TNFRSF7), CD4, CD80, CD86, EGR1, IL12B, IL15, IL2, IRF4, NOS2 (iNOS), PTPRC, SOCS1.
T-Cell Polarization: CCL3, CCR1, CCR2, CCR3, CCR4, CCR5, CD274, CD28, CD4, CD40LG (TNFSF5), CSF2 (GM-CSF), CXCR3, CXCR4, IFNG, IL12A, IL12RB1, IL12RB2, IL18R1, IL2, IL4, IL4R, IL5, TGFB1.
Regulators of Th1 and Th2 Development: CD2, CD40 (TNFRSF5), CD5, CD7, CSF2 (GM-CSF), IFNG, IL10, IL12A, IL13, IL3, IL4, IL5, TLR2, TLR4, TLR9.
Th1 & Th2 Differentiation: CD28, CD40 (TNFRSF5), CD40LG (TNFSF5), CD86, IFNG, IL12A, IL12B, IL12RB1, IL12RB2, IL18, IL18R1, IL2, IL2RA, IL4, IL4R, IL6.
B-Cell Activation:
Antigen Dependent B-cell Activation: CD28, CD4, CD40 (TNFRSF5), CD40LG (TNFSF5), CD80, FAS (TNFRSF6), FASLG (TNFSF6), IL10, IL2, IL4.
Other Genes involved in B-Cell Activation: ADA, CXCR5, ICOSLG, IL6, IL7, MS4A1, TGFB1.
B-Cell Proliferation: BCL2, CD27 (TNFRSF7), CD40 (TNFRSF5), CD81, IL10, IL7, PTPRC.
B-Cell Differentiation: ADA, AICDA, BLNK, CD27 (TNFRSF7), IL10, IL11, IL4, RAG1.
Other Immune Cell Activation:
Macrophage Activation: IL13, IL4, TLR1, TLR4, TLR6.
Neutrophil Activation: IL8.
Natural Killer Cell Activation: CD2, IL12A, IL12B, IL2.
Leukocyte Activation: CX3CL1.
通路研究工具:
?细胞谱系鉴定系列 | PCR Array of Cell Lineage Identification | HU-CLI-084 |
胰岛素抵抗系列 | PCR Array of Insulin Resistance | HU-INR-084 |
T细胞和B细胞激活系列 | PCR Array of T-Cell & B-Cell Activation | HU-TCA-084 |
终末分化指标系列 | PCR Array of Terminal Differentiation Markers | HU-TDM-084 |
PCR Array:

Q-PCR array是信号通路基础生物学研究和临床疾病研究的重要工具。这种功能分类芯片运用成熟的SYBR Green荧光定量PCR技术,专注于一个信号通路中基因的表达水平检测。与传统的高密度表达谱芯片相比,Q-PCR array具有针对性强、灵敏度高、准确可靠等优点。 芯片上的基因包括了与研究对象有确定关系的基因,或至少是与研究对象的关系有待考证的基因。如果研究对象是某一生物学通路的基因,则使用针对该类基因的功能分类基因芯片比使用高密度表搭配芯片更加有效便利。
BioTNT QPCR芯片特点:
l 灵敏度高,样本使用量低;
l 线性范围广,可同时检测表达水平差异大的基因;
l 每个基因的检测引物优化后保证高扩增率和产物单一;
l 重复性高,Ct值的平均差异只有0.25个循环;
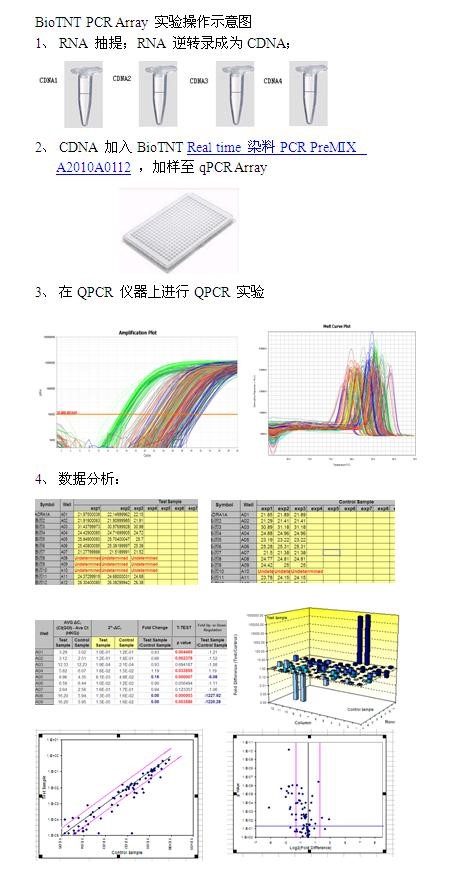
BioTNT QPCR Array芯片操作流程: