其他品牌 品牌
代理商厂商性质
上海市所在地
mini-FIRe浮游植物荧光仪
在实验室和海洋中构建用于测量浮游植物生物量、生理学和光合作用的高级荧光系统
1. 研究目的和内容
研究目的
该项目的目的是建造一种小型的台式仪器,称为F荧光I诱导和R驰预(mini-FIRe)系统,用于离散样品分析和连续测量浮游植物在海洋中的丰度和生理状况。与Rutgers团队发明和开发的前代FRRF和FIRe荧光仪不同,新仪器将表现出增强的灵敏度(约10倍),可实时提供更多生理参数。新仪器的高灵敏度使得它们对于在公海的实地工作有巨大价值。
研究内容
使用可变荧光技术对浮游植物和其他光合作用生物的光合作用活性的评估 - 光合作用生物的生理状态的快速和无损评估依赖于使用快速重复率荧光学 (FRRF) 及其技术后续荧光感应和放松 (FIRE) 技术。这项技术是由Rutgers团队发明和开发的。评估光合作用生物生存能力的基本方法依赖于叶绿素"可变荧光"剖面的测量和分析,叶绿素是光合作用机构*的特性(Falkowski等人于2005年对此进行了审查)。"可变荧光"技术依赖于叶绿素荧光与光合作用过程效率之间的关系,并提供了一套全面的荧光和光合作用参数的有机体。光学测量是灵敏的,快速的,无损的,可以实时和原位完成。
这种方法和已实现的仪器学原理是在同行评审文献中确立的(Falkowski and Kolber 1995; Kolber at al., 1998; Gorbunov et al., 2000, 2001; Gorbunov and Falkowski 2004)。最初是为研究水柱中的浮游植物而开发的,FRR技术提供了准确的信息,说明浮游植物群落的运作以及控制海洋初级生产力的环境因素的影响(e.g., Falkowski and Kolber 1995; Falkowski and Raven 2007; Behrenfeld et al., 1996; Coale et al, 2004; Falkowski et al, 2004)。使用台式和潜水式FRR和FIRe荧光仪成为美国和世界上大多数生物海洋学项目不可分割的一部分。
已开发出F荧光I诱导和R驰预(FIRe)技术 ,以测量光合作用生物的一套全面的光合作用和生理特征(Gorbunov and Falkowski 2005)。 FIRe 技术基于对由一系列激发闪光引起的荧光瞬态的记录和分析,这些闪光的强度、持续时间和间隔精确控制(图 1 和 Gorbunov and Falkowski 2005)。 该技术提供了一套全面的参数,这些参数的特点是光合作用采光过程、光系统 II (PSII) 中的光化学以及光合作用电子传输到碳固定。由于这些过程对环境因素特别敏感,FIRe 技术为识别和诊断自然(营养限制、光化学和光刺激、热应力等)和人为应激因素(如污染)提供了基础。
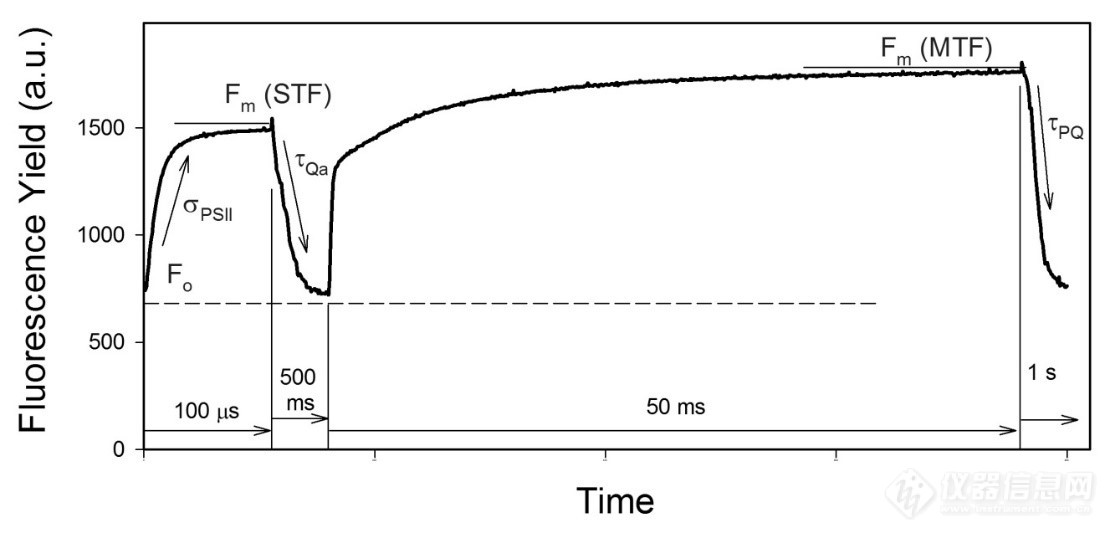
图1。FIRe 荧光瞬时的例子。荧光产量的动力学记录为微秒时间分辨率,包括四个阶段:(第一阶段,100 ms)100 ms的强短脉冲(称为单周转闪光,STF)适用于累积饱和PSII,并测量从Fo到Fm(STF)的荧光感应:(第二阶段,500ms)弱调制光用于记录500ms时间尺度上荧光产量的放松动能:(第三阶段,50 ms)50ms 持续时间的强长脉冲(称为多周转闪光,MTF)用于饱和 PSII 和 PQ 库:(第 4 阶段,1 s) 弱调制光用于记录 PQ 库在 1s 的时间尺度内再氧化的动力学。 第 1 阶段的分析提供:最小和最大荧光产量(Fo,Fm);PSII光化学电荷分离的量子效率Fv/Fm(STF);PSII 的功能横截面,σPSII; 和连接因子(p)。第 2 阶段为 PSII 接收方的电子传输提供时间常数(即Qa 受体侧再氧化)。第 3 阶段提供 Fm(MTF)和 Fv/Fm(MTF)。第 4 阶段揭示了 PSII 和 PSI 之间的电子传输时间常数(PQ 库的再氧化)。
可变荧光技术的生物物理背景- 在室温下,叶绿素荧光主要产生于PSII。当PSII反应中心处于开放状态(Qa氧化)时,荧光产量极小,Fo。当 Qa 还原(例如,通过暴露在强光下)时,反应中心关闭,荧光产量增加到其高水平 Fm。为了检测Fo和Fm,FIRe技术记录了由强烈的饱和脉冲光(~100 μs,称为单周转闪光,STF)引起的荧光感应(图1第1阶段)。荧光感应率与PSII的功能吸收横截面成正比,而荧光上升的相对幅度Fv/Fm则由PSII光化学的量子效率来定义。荧光感应的形状由单个光合作用单元之间的激发量转移控制,并由"连接因子"(Kolber et al. 1998)定义。因此,在没有能量转移(p = 0)的情况下,荧光感应呈指数级,当p 增加到 ~0.5 到 0.7 的最大值时,就会变成反曲线。
PSII 受体侧电子传输的动能(即Qa再氧化)是通过 STF 之后的荧光驰预动力学分析(图 1 第 2 阶段)评估的。荧光动力学由几个部分组成,因为Qa再氧化的速度取决于第二个电子受体Q b的状态,Qb作为移动双电子受体工作:
Qa- Qb → Qa Qb- (150 - 200 ms) (1)
Qa- Qb- → Qa Qb= (600 - 800 ms) (2)
Qa- _ → Qa- Qb → Qa Qb- (~ 2000 ms) (3)
反应 (3) 与 Qb 最初脱离 D1 蛋白结合位点时的条件相对应。此外,一小部分电子传输受损的失活反应中心可能有助于驰预动力学中最慢的组件。FIRe 软件使用 3 组件分析处理驰预动力学,以检索电子传输的时间常数(即 Q 氧化 tQa)。
PSII 和 PSI 之间的电子传输的时间常数 tPSII-PSI 是从多周转闪光(MTF,图 1 中的第 3 阶段和第 4 阶段)之后的荧光驰预动力学分析中检索到的。 在大多数生理条件下,这个时间常数是由质体醌(PQ)库再氧化的速度决定的,并且是一个数量级比tQa慢一个数量级。
测量一系列环境光强的FIRe荧光参数,可以重建光合作用电子传输的速率,Pf,作为光强的函数(光合作用与光强曲线)(Kolber and Falkowski, 1993)。Pf 与光照产物和环境光下测量的光化学量子产量成正比(DF'/Fm')。分析这些光合作用与光强曲线提供了光合作用最大电子传递速率(Pmax)和光饱和系数(Ek)。光合作用与辐射测量使用 FIRe 的光化光源 (ALS) 进行,该光源通过 FIRe 数据采集软件由计算机控制。
研发背景和专业知识 – Rutgers团队的成员在可变荧光技术和方法的研发方面积累了超过 20 年的经验。他们发明并开发了10多项生物物理研究的*仪器(参见相关同行评审出版物的附录参考清单),包括:
● Pump-and-Probe Fluorometer (Kolber and Falkowski, 1986);
● Pump-and-Probe LIDAR (Gorbunov et al. 1991);
● Fast Repetition Rate (FRR) Fluorometers (Kolber at al. 1993; 1998);
● Single-Celled FRR Fluorometer (Gorbunov et al. 1999);
● Diver-operated FRR Fluorometer (Gorbunov et al. 2000);
● Moorable FRR Fluorometer (Gorbunov et al. 2001);
● FIRe System (Gorbunov and Falkowski 2005);
● Diving-FIRe System (Gorbunov 2012);
● Mini-FIRe System (Gorbunov 2013).
2. 仪器介绍
mini-FIRe基于与之前台式FIRe仪器相同的生物物理原理(Gorbunov and Falkowski 2005),但新仪器更紧凑3倍,灵敏度提高10倍。叶绿素浓度的下限低至 ~0.005 mg/m3,这使得mini- FIRe对于在公海进行现场采样非常有价值。
在这里,Rutgers团队提议建造一个mini-FIRe(图2)该仪器将用于离散样品分析(例如,从站点的尼斯金瓶收集的样品)和/或在海洋中持续进行取样。仪器将配备一个流经的样品室,用于连续绘制浮游植物生物量和光合作用特性。以下是mini-FIRe记录的生理参数列表和仪器技术规格mini-FIRe(图2)。该仪器将用于离散样品分析(例如,从站点的尼斯金瓶收集的样品)和/或在海洋中持续进行取样。该仪器将配备一个流经的样品室,用于连续绘制浮游植物生物量和光合作用特性。以下是mini-FIRe记录的生理参数列表和仪器技术规格。
图2 mini-FIRe荧光仪,具有增强的灵敏度。
测量参数:
●暗适应后最小和最大荧光产量(Fo, Fm)
●光适应下有效、最小和最大荧光产量(F', Fo', Fm') *
●光系统II、PSII 中光化学最大有效量子产量(Fv/Fm 和DF'/F m))
●三波长下功能性PSII吸收截面积(sPSII)
●光合作用单元之间的能量转移效率("连接因子")
●PSII 受体侧电子传递时间常数(Q a 到Qb,Qa 到 Qb-)
●PSII 和 PSI 之间的光合作用电子传输时间常数
●电子传递速率,ETR,作为光强的函数 *
●光化学淬火系数 (qP)和非光化学淬火系数 (NPQ) *
●最大光合速率、初始斜率和光合作用周转时间(从 F 与 E 曲线得到)
●这些参数是使用光化光源 (ALS) 测量,并记录为光强曲线。
mini-FIRe 系统的技术规格:
●灵敏度:0.005 - 100 mg/m3叶绿素a(可通过添加中性密度减压过滤器提高采样浓度)
●激发光源:蓝色(峰值波长450 nm,30 nm带宽),绿色(峰值波长530 nm,40 nm带宽),橙色(峰值波长590 nm,30 nm带宽),用于选择性激发不同功能组的浮游植物。
●发射检测:680 nm(叶绿素a)和880 nm(细菌叶绿素a),其他波长可使用可更换的发射滤光片进行选择。
●尺寸: 10 x 5 x 12 英寸
References related to methodology
Peer-Reviewed Publications:
Behrenfeld, M. J., A. J. Bale, Z. S. Kolber, J. Aiken, and P. G. Falkowski. 1996. Confirmation of iron limitation of phytoplankton photosynthesis in the equatorial Pacific Ocean. Nature 383: 508-511.
K.H. Coale, K.S. Johnson, F.P. Chavez, K.O. Buesseler, R.T.. Barber, M.A. Brzezinski, W.P. Cochlan, F.J. Millero, P.G. Falkowski, J.E. Bauer, R.H. Wanninkhof, R.M. Kudela, M.A. Altabet, B.E. Hales, T. Takahashi, M.R. Landry, R.R. Bidigare, X.Wang, Z.Chase., P.G. Strutton, G.E. Friederich, M.Y. Gorbunov, V.P. Lance, A.K. Hilting, M.R. Hiscock, M.Demerest, W.T. Hiscock, K.A. Sullivan, S.J. Tanner, R. M. Gordon, C.L. Hunter, V.A. Elrod, S.E. Fitzwater, S. Tozzi, M. Koblizek, A.E. Roberts, J. Herndon, J. Brewster, N. Ladizinsky, G. Smith, D. Cooper, D. Timothy, S.L. Brown, K.E. Selph, C.C. Sheridan, B.S. Twining, and Z.I. Johnson (2004) - Southern ocean iron enrichment experiment: Carbon cycling in high- and low-Si waters. – Science, 304 (5669): 408-414.
Falkowski PG, Koblizek M., Gorbunov M, and Kolber Z., (2004). Development and Application of Variable Chlorophyll Fluorescence Techniques in Marine Ecosystems. In: “Chlorophyll a Fluorescence: A signature of Photosynthesis” (Eds. C.Papageorgiou and Govingjee), Springer, pp. 757-778.
Falkowski, P.G., and Z. Kolber. (1995). Variations in the chlorophyll fluorescence yields in the phytoplankton in the world oceans. Aust. J. Plant Physiol. 22: 341–355.
Falkowski, P.G. and J.A. Raven. (2007). Aquatic Photosynthesis (2nd edition). Princeton University Press. Princeton, 484 pp.
Gorbunov M.Y., Fadeev V.V., and Chekalyuk A.M. (1991) Method of remote laser monitoring of photosynthesis efficiency in phytoplankton. - Moscow University Physics Bulletin. 46(6): 59?65.
Gorbunov M.Y., Kolber Z., and Falkowski P.G. (1999) Measuring photosynthetic parameters in individual algal cells by Fast Repetition Rate fluorometry. - Photosynthesis Research, 62(2-3): 141-153.
Gorbunov M.Y., Falkowski P.G. and Kolber Z. (2000) Measurement of photosynthetic parameters in benthic organisms in situ using a SCUBA-based fast repetition rate fluorometer. - Limnol. Oceanogr., 45(1):242-245.
Gorbunov M.Y., Z. Kolber, M.P. Lesser, and P.G. Falkowski P.G. (2001) Photosynthesis and photoprotection in symbiotic corals. - Limnol. Oceanogr., 46(1):75-85.
Gorbunov MY, and Falkowski PG. (2005). Fluorescence Induction and Relaxation (FIRe) Technique and Instrumentation for Monitoring Photosynthetic Processes and Primary Production in Aquatic Ecosystems. In: “Photosynthesis: Fundamental Aspects to Global Perspectives” - Proc. 13th International Congress of Photosynthesis, Montreal, Aug.29 – Sept. 3, 2004. (Eds: A. van der Est and D. Bruce), Allen Press, V.2, pp. 1029-1031.
Kolber, Z., and Falkowski, P.G., (1993) Use of active fluorescence to estimate phytoplankton photosynthesis in situ, Limnol. Oceanogr., 38, 1646-1665, 1993.
Kolber, Z., O. Prasil, and P.G. Falkowski (1998). Measurements of variable chlorophyll fluorescence using fast repetition rate techniques: defining methodology and experimental protocols. Biochem. Biophys. Acta 1367: 88-106.
Lin H., Kuzminov F.I., Park J., Lee S.H., Falkowski P.G., and Gorbunov M.Y. (2016) The fate of photons absorbed by phytoplankton in the global ocean – Science, 351(6270), pp. 264-267.
Park J., Bailleul B., Lin H., Kuzminov F.I., Yang E.J., Falkowski P.G., Lee S.H., and Gorbunov M.Y. (2017) Light availability rather than Fe controls the magnitude of massive phytoplankton bloom in the Amundsen Sea polynyas, Antarctica – Limnology and Oceanography, DOI: 10.1002/lno.10565.
Thamatrakoln K., Bailleul B., Brown C.M., Gorbunov M.Y., Kustka A.B., Frada M., Joliot P.A., Falkowski P.G., Bidle K.D. (2014) Death-specific protein in a marine diatom regulates photosynthetic responses to iron and light availability - Proc. Natl. Acad. Sci USA, vol. 110, no. 50: 20123-20128. doi:10.1073/pnas.1304727110.